Introducción
Los pigmentos en los organismos vivos cumplen diferentes funciones, entre ellas, como mecanismos de defensa para asegurar su desarrollo, supervivencia y procreación (Shamim y col., 2014). En los sistemas marinos algunos organismos, además de la pigmentación, poseen la capacidad de producir corazas o caparazones duros, otros son capaces de nadar, volar o correr a velocidades tales que logran escapar de posibles depredadores. Sin embargo, hay otros que su único sistema de protección son los cambios de color, como es el caso de los calamares (Ezquerra y Aubourg, 2019). Los cambios de coloración les permiten cambiar su apariencia y mimetizarse con el medio en el que habitan, mediante la síntesis acelerada de pigmentos o la modulación de células especializadas (cromatóforos) en la superficie de la piel (Chan-Higuera, 2019b). Muchas veces, la actividad de estos pigmentos va más allá del simple cambio de la coloración del organismo para mimetizarse con el entorno. La pigmentación en los organismos también sirve para alertar a los demás organismos de que son tóxicos (aposematismo).
Por otro lado, los organismos productores primarios de la cadena trófica se caracterizan por utilizar pigmentos para lograr captar y aprovechar la luz proveniente del sol, como fuente de energía. Plantas, algas y algunas bacterias son capaces, a través de pigmentos fotosintéticos, de realizar los procesos metabólicos necesarios para realizar esta función vital. De igual manera, la funcionalidad de dichos compuestos también ha sido vinculada a actividades biológicas, útiles en la supervivencia de los organismos marinos (Hsu y col., 2013).
Los pigmentos de los organismos marinos han sido de especial interés desde hace algunas décadas, debido a sus estructuras particulares y la potente actividad antioxidante que les confieren.
El objetivo de este trabajo fue compilar y describir estudios que muestran los mecanismos de acción de diferentes pigmentos con actividad antioxidante, provenientes de algunos organismos marinos. En la compilación de la información se utilizaron las bases de datos Scopus®, Web of Science™ y Microsoft Academic, buscando fuentes de reciente publicación (preferentemente de 10 años o menos de antigüedad), en referencias redactas en inglés, las cuales estuviesen relacionadas con la elucidación de actividad antioxidante de pigmentos de organismos marinos.
Azafilonas
Las azafilonas son pigmentos que pertenecen a la categoría de los policétidos. Estos compuestos se caracterizan por tener en su estructura grupos carbonilo (-CO-) y metileno (-CH2-) alternados (Miyanga, 2017).
Las azafilonas han sido aisladas e identificadas principalmente a partir de hongos, de una gama diversa de especies del género Monascus, un hongo terrestre, cuya especie M. purpureus se caracteriza por su apariencia rojiza; sus propiedades como colorante y conservador se aprovechan desde la antigüedad (Wu y col., 2018). Así mismo, las azafilonas bioactivas han sido encontradas en hongos saprófitos de zonas acuáticas (Pleosporales sp.), hongos acuáticos como Penicillium sclerotiorum, Chaetomium sp., Peyronellaea glomerata, así como algunas esponjas marinas. Sin embargo, en el caso de estos últimos organismos, la evidencia sugiere que la presencia de azafilonas es derivada de la interacción simbiótica con hongos productores de pigmentos derivados de azafilonas (Jia y col., 2019).
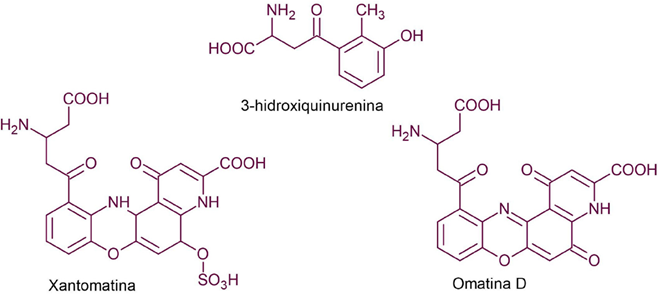
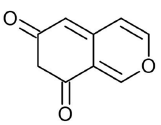
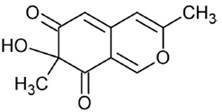
Las azafilonas, en su estructura cuentan con un núcleo de 2 anillos de piranoquinona altamente oxigenado, conocido como isocromo, así como un centro de carbono cuaternario. Estos pigmentos tienen como característica la capacidad de volverse de color rojo, en presencia de aminas primarias, cuando un átomo de nitrógeno sustituye al oxígeno del anillo de pirano. La saturación de los anillos del cromóforo policético también ocasiona un cambio en la coloración: la presencia de un doble enlace genera colores naranjas, y en ausencia, la apariencia es amarilla (Chen y col., 2017). El precursor y las principales azafilonas identificadas en organismos marinos se muestran en la Tabla 1.
Table 1 Main azaphilones found in marine organisms.
| Molécula | Estructura |
|---|---|
| Precursor oxigenado de azafilonas |
|
| Precursor nitrogenado de azafilonas |

|
| Ácido pulvilónico |

|
| Austdioles |
|
| Chaetoviridinas |

|
| Esclerotiorinas |

|
Fuente: modificada a partir de Chen y col., 2020.
El efecto antioxidante de siete azafilonas y derivados de ellas ha sido establecido por varios grupos de investigación. Así, se tiene que los extractos metanólicos obtenidos a partir del hongo Monascus sp. demostraron tener actividad como antioxidante primario y secundario, logrando inhibir radicales sintéticos y retardando la peroxidación de los ácidos grasos presentes en las muestras. Las azafilonas presentaron comportamientos similares a compuestos antioxidantes sintéticos, en cuanto la capacidad de inhibir los radicales 2,2-difenil-1-picrilhidrazilo (DPPH), 2,2’-azino-bis (3-etilbenzotiazolin-6-ácido sulfónico) (ABTS+) y iones superóxido (Yang y col., 2006). Se ha estudiado la utilización de azafilonas y sus derivados como posibles compuestos con potencial efecto protector durante a la disminución de oxígeno (hipoxia) (Li y col., 2018).
La actividad biológica de las azafilonas es dependiente de la estructura química. El potencial antioxidante se atribuye principalmente a dos mecanismos diferentes: la reacción directa entre radicales y los grupos hidroxilo unidos a anillos aromáticos, y la transformación de la molécula en piridonas (Chen y col., 2020). Varios autores reconocen como un paso clave, en la expresión de la actividad biológica de las azafilonas, la producción de compuestos derivados de la 4-piridona. Esta molécula (junto a su tautómero, el piridin-4-ol) se caracterizan por actuar como potentes antioxidantes, dada la reactividad de los grupos vinilo. Si bien, el mecanismo de transformación aún no está del todo esclarecido, se ha demostrado la relación estructura-función de las piridonas obtenidas a partir de las azafilonas (Gao y col., 2013). Los estudios descritos demuestran cómo las azafilonas y sus derivados son capaces de ejercer un efecto antioxidante desde la perspectiva farmacológica, así como en la conservación de alimentos.
Carotenoides
Los carotenoides son pigmentos producidos por organismos fotosintéticos, así como algunas especies de bacterias, hongos y levaduras. A pesar de que ciertos animales marinos son asociados a coloraciones naranjas intensas en sus músculos (salmónidos) o en sus exoesqueletos (crustáceos), dichos organismos son incapaces de sintetizar carotenoides: estos pigmentos son ingeridos en la dieta (obtenidos de organismos productores en la cadena trófica) y almacenados para su posterior utilización. Se dividen en xantofilas (conteniendo átomos de oxígeno) y carotenos (sin oxígeno en sus estructuras) (Maoka, 2011; Sy y col., 2015).
Los carotenoides son compuestos liposolubles, caracterizados por cadenas insaturadas de aproximadamente 40 carbonos, los cuales se distinguen por la presencia de anillos en los carbonos ubicados en los extremos. Generalmente, los carotenoides obedecen a la clasificación de tetraterpenoides, que contienen dobles enlaces conjugados. Estas características estructurales les confieren atributos que hacen a los carotenoides pigmentos versátiles en funcionalidad y aplicación (Sy y col., 2015).
Los principales carotenoides de origen marino con actividad antioxidante reconocida en modelos in vitro e in vivo son, b-caroteno, fucoxantina, astaxantina y la cantaxantina. La fucoxantina es un carotenoide encontrado en las algas marinas cafés. Se trata de una molécula de 42 carbonos, con 2 anillos en los carbonos extremos de la cadena hidrocarbonada central. La presencia de un grupo epóxido y de un grupo carbonilo conjugado, en una cadena de polieno, confiere a la fucoxantina la capacidad de interactuar con los radicales libres, previniendo el daño que estos podrían desencadenar (Figura 1).

La fucoxantina obtenida de tres diferentes algas cafés (Fucus serratus, Fucus vesiculosus y Laminaria digitata) fue evaluada en función su actividad antioxidante por Sathasivam y Ki, 2018. Estos autores determinaron la actividad de inhibición del radical DPPH y la actividad quelante del ion hierro Fe2+. Si bien la fucoxantina tenía una actividad inhibitoria de DPPH menor que la del butilhidroxitolueno (BHT), demostró una actividad similar a la del ácido etilendiaminotetraacético (EDTA) en la actividad quelante del hierro. La actividad antioxidante de la fucoxantina también se ha demostrado en modelos alimentarios. En la emulsión de agua y aceite de pescado al 5 %, en presencia de hierro como inductor de oxidación, la fucoxantina mostró una mayor actividad antioxidante en comparación con el BHT, con niveles bajos de productos volátiles y reducción de la pérdida de tocoferol como medida de la oxidación.
También se ha evaluado la actividad antioxidante de la fucoxantina obtenida de la microalga Phaeodactylum tricornutum, por los métodos de inhibición de DPPH, peróxido de hidrógeno y eliminación del radical superóxido. Se encontró que la fucoxantina era más potente como antioxidante que el ácido ascórbico, butilhidroxianisol y tocoferol (Kawee-ai y col., 2013).
Entre los carotenoides de origen marino más representativos y de los que se reconoce una gran variedad de actividad biológica, destaca la astaxantina. Estructuralmente hablando, es una molécula que se compone de áreas polares (anillos localizados en los extremos) y áreas apolares (cadena de carbonos con enlaces insaturados) (Figura 1). La actividad antioxidante de la astaxantina se debe a la combinación de estas dos áreas, las cuales permiten una interacción con los radicales y una capacidad de remover electrones de alta energía (Dose y col., 2016). Otra característica remarcable es la capacidad de mantener su estructura química, aún si ya participó en reacciones redox con radicales libres. Se reconoce a la astaxantina como un potente antioxidante, de hasta 10 veces mayor actividad, en comparación con otros carotenoides (Gammone y col., 2015).
El potencial de inhibición de radicales se ha logrado establecer con el DPPH, ABTS+ y ensayos de extinción de oxígeno singlete (1O2). El cual está vinculado con la generación de especies reactivas y radicales libres, así como con reacciones de oxidación celular y la prevención de blanqueo del betacaroteno. Chintong y col. (2019) realizaron la comparación de la actividad antioxidante de luteína, astaxantina, zeaxantina, acetato de tocoferol y ácido ascórbico y establecieron la dosis requerida contra el peróxido de hidrógeno y el radical superóxido de la astaxantina, luteína y zeaxantina, confirmando así la fuerte actividad antioxidante de las xantofilas (carotenoides con uno o más átomos de oxígeno en su estructura). Desde la perspectiva de actividad antioxidante y su posible efecto en la salud humana, se han medido los efectos protectores de la zeaxantina, astaxantina y luteína contra las células del neuroblastoma humano, contra el daño del ácido desoxirribonucleico (ADN) causado por especies de nitrógeno reactivo (Santocono y col., 2007).
La cantaxantina es un carotenoide del orden de las xantofilas, la cual es un intermediario en la síntesis de astaxantina. Es sintetizada por especies de algas, tales como Dactylococcus dissociatus, Haematococcus pluvialis y Chlorella zofungiensis, por mencionar algunas. En la actualidad, este pigmento se utiliza como aditivo y como suplemente alimentario, dada la evidencia que demuestra su actividad antioxidante (Venugopalan y col., 2013). La isomerización geométrica se sugiere como un factor que impacta sobre la actividad captadora de radicales libres de la cantaxantina. Se ha demostrado que la 9-Z-cantaxantina es más eficaz que la E-cantaxantina total para inhibir a los radicales superóxido (Figura 1).
Además, la cantaxantina es un potente antioxidante lipofílico, que logra inhibir y “neutralizar” el oxígeno singlete, capaz de eliminar las especies reactivas de oxígeno; sin embargo, es ineficaz para inhibir los radicales libres del anión peroxinitrito (ONOO-) (Chang y col., 2013). Las xantofilas, en particular la astaxantina y la cantaxantina poseen una mayor capacidad antioxidante y para eliminar radicales libres que otros carotenoides, como el licopeno y el betacaroteno. Estas capacidades se atribuyen al grupo ceto, en conjugación con el esqueleto de polieno, al cual se considera que estabiliza los radicales centrados en carbono de manera más efectiva que el esqueleto de polieno por sí solo (Sy y col., 2015).
La capacidad antioxidante de la cantaxantina se ha determinado tanto en análisis in vitro como en estudios in vivo, mediante el empleo de cultivos celulares. La suplementación con cantaxantina resultó ser capaz de provocar efectos moduladores sobre la peroxidación de lípidos y las actividades de las enzimas antioxidantes, en ratas que recibieron una dieta alta en grasa y colesterol. Estos hallazgos sugieren que la cantaxantina alteró el equilibrio prooxidativo/antioxidante y redujo el estrés oxidativo inducido por el colesterol, al modular los mecanismos de defensa antioxidantes endógenos (Shih y col., 2008).
Clorofilas
Las clorofilas son un grupo de pigmentos sintetizados por organismos productores en la cadena trófica (plantas y algas). Su principal función es permitir la utilización de la energía proveniente de la luz solar, para llevar a cabo procesos metabólicos donde se requiere gasto energético. Las clorofilas se dividen en función de su estructura química y la variación de sus sustituyentes, siendo las más comunes la clorofila a y la b, pero existen también la clorofila c1, c2, d y f. De manera general, se caracterizan por la presencia de un quinto anillo más allá de los cuatro anillos pirrol. La mayoría de las clorofilas se clasifican como clorinas, que son compuestos reducidos de las porfirinas. Tienen un átomo de magnesio unido al centro de los anillos aromáticos. El anillo de clorina puede tener varias cadenas laterales, que generalmente incluyen una cadena larga de fitol, un alcohol diterpénico acíclico (Nagini y col., 2015). Para ejemplificar lo anteriormente descrito, se muestra la Figura 2.
La capacidad antioxidante de la familia de clorofilas a es significativamente mayor que la de la familia b; a su vez, los derivados libres de metales (solamente los esqueletos carbonados) exhiben una menor actividad antirradical que los metalo-derivados (Hsu y col., 2013). El mecanismo antirradical propuesto de estos pigmentos de clorofila está basado en dos arreglos estructurales: el radical catión p en la estructura de la porfirina y la presencia de iones metálicos quelados. El primero contribuye a la donación eficaz de electrones para romper la reacción en cadena y el segundo acentúa esta capacidad mediante la concentración de la densidad de electrones hacia el metal delimitado central y contra las cadenas hidrocarbonadas de la porfirina (Başkan y col., 2013).
La capacidad antioxidante de las clorofilas puede ser explicada desde dos mecanismos distintos: debido a la interrupción de la reacción en cadena de la peroxidación, por la interacción directa con radicales oxigenados (peroxi, alcoxi), y por otro lado, la posible descomposición de los hidroperóxidos. Experimentalmente, se probó la última teoría utilizando hidroperóxidos del ácido linoleico, en combinación con clorofila y feofitina (Rigane y col., 2013). Ninguno de los dos compuestos fue capaz de descomponer los hidroperóxidos, demostrando que el efecto antioxidante debe estar mediado por la interacción con los radicales. Utilizando el radical DPPH, se encontró que la clorofila tiene la capacidad de donar átomos de hidrógeno, como su método de actividad antirradical. La evidencia demostró que la clorofila a fue capaz de neutralizar al DPPH, pero no de detener la oxidación mediada por radicales peroxilo. Estos hallazgos demuestran que la clorofila a, así como la feofitina, actúan como antioxidantes en etapas iniciales de la peroxidación (Fernandes y col., 2017).
La capacidad de actuar como agente antioxidante, evaluada a través del método de DPPH, se incrementó a medida que se encontraban en el medio una mayor cantidad de microalgas. En otro estudio, se observó que la fracción de clorofila obtenida de la Phormidium autumnale resultó ser 200 veces más potente que el a-tocoferol para captar los radicales peroxilo (Hsu y col., 2013).
En las clorofilas, aunque son reconocidas como agentes antioxidantes, también existe evidencia que establece su efecto prooxidante en aceites, a través del mecanismo de la formación del oxígeno singlete. El rol dual de las clorofilas depende, en gran parte, de la presencia de luz, dada la función original de la clorofila de aprovechar la luz solar como fuente de energía (Rigane y col., 2013).
Polihidroxinaftoquinonas
Los pigmentos del grupo de las polihidroxinaftoquinonas (PHNQ) son compuestos encontrados en diversas especies marinas, principalmente erizos de mar. Se les suele dividir en equinocromos y espinocromos, siendo los primeros aislados de órganos internos y los últimos son encontrados en las espinas y conchas de los erizos de mar (Hou y col., 2020a). Los espinocromos son derivados polihidroxilados de la 5-hidroxi-1,4-naftoquinona (conocida también como juglona) o de la 5,8-dihidroxi-1,4-naftoquinona (naftazarina). Estas moléculas están sustituidas con varios grupos funcionales, como metoxilo, etilo, acetil y amino (Hou y col., 2020a). La estructura de los principales PHNQ, encontrados en especies marinas, se muestra en la Figura 3.

Las estructuras de los PHNQ (con varios grupos OH unidos a anillos aromáticos) pueden actuar como captadores de radicales, la cual es la actividad más abundante reportada para los pigmentos de erizos de mar (Hou y col., 2020b). Un punto por resaltar es que, si bien, estos pigmentos están conformados por compuestos altamente hidroxilados, no todos los grupos OH de estas moléculas actúan como donantes de hidrógeno para eliminar los radicales libres. Así, se ha establecido que, la actividad captadora de radicales de los PHNQ depende, además del número, de la posición de los grupos hidroxilo (Lebedev y col., 2005). En el caso de los pigmentos diméricos, pueden donar 4, 5 y 6 protones, exhibiendo así una mayor capacidad antioxidante, en comparación de los monómeros (Valery y col., 2015).
Soleimani y col. (2016) reportaron que los extractos de pigmentos extraídos de los órganos internos del erizo de mar Echinometra mathaei poseían capacidad reductora del ion férrico (FRAP) y de eliminar radicales libres (DPPH), y que su efecto era dependiente de la concentración utilizada en los ensayos. Polonik y col. (2018) establecieron que un radical DPPH elimina un átomo de hidrógeno del grupo hidroxilo de PHNQ, para convertirse en una estructura diamagnética estable. Al obtener dos átomos de hidrógeno secuencialmente, PHNQ se convierte en naftosemiquinona como producto medio y naftotetracetona como producto de reacción final.
Con respecto a la contribución de los grupos hidroxilo, sobre la actividad antioxidante de los PHNQ, se evaluó la capacidad antioxidante de la 2-metil-1,4-naftoquinona (carente de grupos hidroxilo en la molécula) contra la peroxidación lipídica microsomal, en presencia de NADPH. Los resultados reportados sugieren que no solo los grupos hidroxilo, sino también otros factores, podrían estar involucrados en la actividad antioxidante de los pigmentos de naftoquinona del exoesqueleto de erizo de mar (Zhou y col., 2011). Si bien, algunos grupos hidroxilo fenólicos presentes en los pigmentos, así, como, en otros polifenoles antioxidantes, deben jugar un papel importante en las propiedades antioxidantes observadas en este estudio; la sustitución de grupos hidroxilo por metoxilos en la molécula de naftoquinona provoca un cambio en la actividad antioxidante. Recientemente se ha demostrado que los PHNQ aminados son más potentes antioxidantes que sus análogos hidroxilados (Li y col., 2013).
Omocromos
Los omocromos son pigmentos sintetizados por invertebrados, como crustáceos insectos y cefalópodos (Shamim y col., 2014). Su estructura química es parte del grupo tricíclico de compuestos y tiende a solubilizarse en ácidos y álcalis (Figura 4). La síntesis de omocromos proviene del triptófano, el cual se considera tóxico en altas concentraciones, y está relacionada con proceso de eliminación. Este aminoácido se me-taboliza a través de la vía metabólica de la quinurenina y la 3-hidroxiquinurenina hasta ser transformado en omocromos (Shamim y col., 2014; Dontsov y col., 2020a).
Debido a su naturaleza, los omocromos son pigmentos fotoprotectores. Los tejidos más afectados por la luz son los dérmicos y los oculares, principalmente porque la peroxidación lipídica ocurre con mayor frecuencia en las células sensibles a la radiación. Los omocromos pueden actuar como antioxidantes y el mecanismo antioxidante que pueden llevar a cabo sigue una de las siguientes alternativas: unir metales y ejercer actividad quelante, y pueden actuar como antioxidantes primarios al eliminar los radicales, como los aniones superóxido y el oxígeno singlete (Dontsov y col., 2020b).
La actividad antioxidante de los omocromos contra la oxidación de la cardiolipina ha sido demostrada. Utilizando extractos de pigmentos visuales, específicamente ominas (omocromos de alto peso molecular), se evaluó su efecto sobre la oxidación mediada por hierro de la cardiolipina, en el crustáceo Mysis relicta. El mecanismo está relacionado con el efecto quelante de los omocromos contra la oxidación mediada por hierro, porque su forma ferrosa es un conocido estimulador de la peroxidación lipídica (Dontsov y col., 1999). Para observar y determinar los factores que impactan en la síntesis de omocromos, se compararon las poblaciones de crustáceos de mar y lago (Mysis relicta) en función de su estado oxidativo. La formación de sustancias reactivas al ácido tiobarbitúrico (TBARS, por sus siglas en inglés: Thiobarbituric acid Reactive Substances) fue inversamente proporcional a la concentración de ominas. Los crustáceos de mar tenían una mayor concentración de omocromos, consistente con su mayor resistencia a la luz brillante. Esta evidencia establece, además, la relación entre la producción de antioxidantes endógenos y la exposición a la luz (Zak y col., 2013).
Los estudios realizados en la 3-hidroxiquinurenina indican que su papel puede ser dual (agente pro-oxidante, y a su vez, protector). Ramírez-Ortega y col. (2017) reportaron que esta molécula logró proteger los adipocitos contra la peroxidación lipídica y el daño celular inducido mediado por sulfato de cobre. La presencia de la 3-hidroxiquinurenina y el ácido 3-hidroxiantranílico causaron una disminución del 70 % de la oxidación del glutatión, en comparación con el grupo control. El mecanismo que sigue este precursor de omocromos es posiblemente a través de una interacción directa en las reacciones en cadena que generan los radicales libres.
A través de métodos de predicción computarizada, se estimó la actividad antioxidante de los omocromos. Se encontró que todos los omocromos evaluados eran donantes de electrones, aunque era factible llevarse a cabo solo con la quinurenina, la 3-hidroxiquinurenina y omatina D. Para el mecanismo de transferencia de átomos de hidrógeno, el mejor antioxidante se estimó sería la omatina D (Romero y Martínez, 2015).
Con respecto a la aplicación de los omocromos, se ha logrado observar el efecto de los pigmentos de piel de calamar gigante (Dosidicus gigas) en la estabilidad y vida de anaquel de pescado fresco, donde se estableció cómo estos pigmentos, con actividad antioxidante, lograban prolongar la frescura de filetes de merluza y caballa (Ezquerra-Brauer y col., 2017). También se ha mostrado su eficacia en la prevención de la oxidación de aceite de pescado, evaluada con los parámetros de dienos conjugados, peróxidos y TBARS (Aubourg y col., 2016). De igual manera, estos extractos se incluyeron en la formulación de paté de atún, donde la adición de los mismos logró mantener la calidad y estabilidad oxidativa de las muestras donde fueron añadidos los omocromos de calamar gigante (Chan-Higuera y col., 2019a). Para establecer la molécula responsable de la actividad antioxidante observada por los métodos de DPPH, ABTS y FRAP, se fraccionó y se caracterizaron químicamente los compuestos presentes en los pigmentos de piel de calamar gigante (Dosidicus gigas). A través de métodos espectrofotométricos, se logró identificar al omocromo xantomatina, una molécula del grupo de las omatinas (Chan-Higuera y col., 2019b).
Los pigmentos, como azafilonas, carotenoides, clorofilas, polohidroxinaftoquinonas y omocromos, derivados de organismos marinos como erizos, calamares, algas marinas, bacterias y hongos, a pesar de tener diferentes mecanismos de acción, se les reconoce una potente actividad antioxidante (Lebedev y col., 2005; Baskan y col., 2013; Chang y col., 2013; Chen y col., 2017; Chan-Higuera y col., 2019b). La aplicación e interpretación de esta información permitiría determinar con mayor precisión su posible aplicación en la industria, al sustituir a algunos de los antioxidantes sintéticos utilizados en la actualidad.
Conclusiones
En la búsqueda de nuevos métodos de supervivencia, los organismos marinos han desarrollado la capacidad de sintetizar compuestos que ayuden en mantener su existencia en ambientes hostiles. Actualmente, son estos mismos compuestos los que están siendo aprovechados, por sus actividades biológicas, como agentes terapéuticos frente a enfermedades asociadas al estrés oxidativo, así como representar alternativas de origen natural a los conservadores y aditivos alimentarios. Los pigmentos de organismos marinos representan opciones prometedoras en áreas como la farmacéutica, la alimentaria y la cosmética, principalmente por su actividad antioxidante. Las azafilonas, carotenoides, clorofilas, polihidroxinaftoquinonas y omocromos, descritos en esta revisión, poseen propiedades que van más allá de la actividad antioxidante y que trastocan la aplicación como agentes quimiopreventivos. En el futuro, las investigaciones podrían ser enfocadas hacia los mecanismos específicos de cada pigmento evaluado, desde la perspectiva particular de la aplicación que se está sugiriendo, ya sea como un fármaco, como un aditivo alimentario o un conservador.











 nueva página del texto (beta)
nueva página del texto (beta)