Introducción
Los ambientes extremos incluyen altas y bajas temperaturas, pH, concentraciones de sales, así como altas presiones, altos niveles de radiación, metales pesados y compuestos tóxicos, como los solventes orgánicos. Los microorganismos que viven en estos ambientes se conocen como extremófilos (Merino et al. 2019). La mayoría de los microorganismos extremófilos conocidos pertenecen a las Archaea y Bacteria, aunque también se han caracterizado algunos miembros de los Eukarya, como los protistas y algunas formas multicelulares (Segura et al. 2020). Los microorganismos que habitan en ambientes extremos poseen diversidad genética y metabólica, lo que, aunado a su rápido crecimiento y habilidad para intercambiar genes, les permiten vivir prácticamente en cualquier hábitat y adaptarse a condiciones ambientales cambiantes (Cervantes-de-la-Cruz et al. 2020). Además, los extremófilos han desarrollado diversas estrategias de adaptación a las condiciones extremas de su hábitat, las cuales se presentan tanto a nivel intracelular como extracelular y comprenden la biosíntesis de productos para la protección de la célula, y macromoléculas biológicas, como enzimas y polímeros extracelulares (Kour et al. 2019). Los biocatalizadores que los extremófilos producen como resultado a estas adaptaciones, son únicos e interesantes porque son más estables a las condiciones de reacción industriales ya que presentan mayor estabilidad a altas temperaturas, pH extremo, y generalmente son resistentes a desnaturalizantes químicos, como detergentes y solventes orgánicos; en comparación con las enzimas caracterizadas bioquímicamente de microorganismos mesofílicos, los cuales no soportan estas condiciones por su falta de estabilidad a altas temperaturas ó pH extremo (Cabrera y Blamey 2018). Existe un gran interés en la aplicación industrial de enzimas de extremófilos, ya que además de mayor estabilidad, su uso puede conducir a la sustentabilidad industrial, debido a que muestran beneficios ambientales como biodegradabilidad, disminución en la cantidad de productos de desecho y emisiones contaminantes, así como menor consumo de energía (Bhatia et al. 2021).
En México hay diversos hábitats extremos de donde se han aislado bacterias y arqueas de sitios como pozos petroleros, aguas termales, zonas desérticas, suelos alcalinos y zonas volcánicas (Medrano-Santillana et al. 2017), lo que sugiere gran potencial por descubrir nuevas especies de microorganismos extremófilos con capacidades metabólicas de interés biotecnológico para el desarrollo de nuevos bioproductos (Ortiz-Cortés et al. 2019). Uno de estos hábitats extremos es el valle de Cuatrociénegas, Coahuila, el cual pertenece a la región conocida como Desierto Chihuahuense o Desierto del Norte de México. Dentro de este desierto, el valle de Cuatrociénegas es considerado como el humedal más importante (Montiel-González et al. 2018). El clima de este desierto es muy seco, semicálido, con pocas lluvias, con una precipitación anual de 150 mm; en invierno se alcanzan temperaturas por debajo de los 0 °C, mientras que en verano se exceden los 44 °C (Medina-Chávez et al. 2020). Su complejo hidrológico está interconectado y está compuesto por alrededor de doscientos manantiales, los cuales se conocen localmente como pozas, y varían en número y extensión al estar condicionadas por la disponibilidad de agua (García-Reza et al. 2021). Algunos de los manantiales son termales y se caracterizan por la dureza de sus aguas y por ser extremadamente oligotróficas, debido a los bajos niveles de fósforo (<1 µmol PO4 3−) (Valdivia-Anistro et al. 2016). Además, cuenta con suelos salinos y desiertos formados de arena que se presentan como dunas de yeso, las cuales tienen un contenido de CaSO4 -2H2O de 95% (Delgado-García et al. 2018). Se considera como Reserva de la Biosfera, debido a la gran biodiversidad y riqueza en especies endémicas que presenta (Taboada et al. 2018). Se decretó como área natural protegida en la categoría de Área de Protección de Flora y Fauna en 1994. A nivel internacional es considerado como sitio prioritario para mantener su conservación, por la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO), el Fondo Mundial para la Naturaleza (WWF), el Convenio de Ramsar y el Hombre y la Biosfera por la UNESCO (Souza e Eguiarte 2018). Se han realizado diversos estudios de metagenómica para conocer la diversidad microbiana presente en los ecosistemas del valle de Cuatrociénegas, lo que ha permitido determinar nuevas especies y géneros microbianos; como Bacillus coahuilensis, una bacteria aislada de una laguna localizada en el sistema hidrológico El Churince, la cual se ha adaptado a las condiciones de extrema oligotrofía (Gomez-Lunar et al. 2018). Además, se ha reportado alta diversidad morfológica y taxonómica de bacterias del filo Actinobacteria aisladas del mismo sistema hidrológico, que pertenecen a los géneros Streptomyces, Nocardia, Nocardiopsis, Arthrobacter, Microbacteriumy Micrococcus (Arocha-Garza et al. 2017).
Existen más de 200 pozas en el valle, de las cuales menos de un tercio han sido estudiadas para su caracterización microbiana y bioprospección (Cervantes-de-la-Cruz et al. 2020). La diversidad microbiana de Cuatrociénegas es de interés biotecnológico, debido a que estos microorganismos presentan diversas adaptaciones estructurales y bioquímicas que les permiten sobrevivir a las condiciones desérticas del valle. Estas adaptaciones incluyen diversos mecanismos metabólicos, como la biosíntesis de productos para la protección de la célula y macromoléculas biológicas, como enzimas y polímeros extracelulares (Kour et al. 2019). Por lo tanto, esta diversidad microbiana, representa una fuente valiosa de moléculas bioactivas (Arocha-Garza et al. 2017), como enzimas, biopolímeros, osmolitos y pigmentos carotenoides, los cuales tienen un inmenso potencial biotecnológico para el desarrollo de nuevos bioproductos con aplicaciones en la agricultura, industria química, farmacéutica, alimenticia, materiales y biorremediación. Por lo tanto, la bioprospección de los microorganismos del valle de Cuatrociénegas representa un gran potencial para el descubrimiento de nuevas especies microbianas con capacidades metabólicas interesantes para la industria. Por lo que, el objetivo del presente trabajo fue caracterizar fisiológica y molecularmente una bacteria aislada de la Poza del Centro de Cuatrociénegas, para conocer su capacidad enzimática y determinar su potencial biotecnológico.
Materiales y métodos
Toma de muestras
Se utilizó una cepa aislada en un trabajo anterior por el Departamento de Biotecnología de la Universidad Autónoma de Coahuila, procedente de la Poza del Centro de Cuatrociénegas, Coahuila, en las coordenadas 102° 09’ 15” de longitud y 26° 50’ 44” de latitud, a temperatura in situ de 24 °C y pH 8. Se llevó a cabo la reactivación de la cepa en agar y caldo nutritivo, y después para confirmar la pureza de la cepa, se preparó caldo nutritivo 8 g L−1 y se adicionó extracto de levadura 5 g L−1 (como fuente de nitrógeno y vitaminas) y glucosa 1 g L−1 (como fuente de carbono), como medio de enriquecimiento, de acuerdo al método reportado por Bonilla-Salinas et al. (2004).
Caracterización microbiológica y pruebas fisiológicas
Se observaron las características morfológicas de las colonias de la cepa y se prepararon frotis para su observación microscópica. La composición del medio de cultivo que se utilizó para las pruebas fisiológicas contenía por litro: K2HPO4 0.3 g, KH2PO4 0.3 g, MgCl2·6H2O 0.2 g, CaCl2·2H2O 0.1 g, KCl 0.1 g, NaCl 1 g, NH4Cl 1 g, CH3COONa 10 mM, extracto de levadura 1 g, y 10 mL de una solución de minerales traza, la cual contenía por litro ácido nitrilotriacético 1.5 g, MgSO4 •7H2O 3 g, MnSO4 •2H2O 0.5 g, NaCl 1 g, FeSO4 •7H2O 0.1 g, CoCl2 ó CoSO4 0.1 g, CaCl2 •2H2O 0.1 g, ZnSO4 0.1 g, CuSO4 •5H2O 0.01 g, AlK (SO4)2 0.01 g, H3BO3 0.01 g, Na2MoO4 •2H2O 0.01 g. Los efectos de la temperatura, pH y concentraciones de sales se determinaron mediante turbidimetría (densidad óptica) de los cultivos a 600 nm utilizando un espectrofotómetro Varian Cary 50 Scan UV -visible. Para determinar el pH óptimo y los rangos de crecimiento de pH de la cepa, se ajustó el pH del medio de cultivo a 5, 6, 7, 8 y 9 utilizando HCl ó KOH 1 M. Para determinar el efecto de la temperatura se probaron las siguientes temperaturas de incubación: 15, 25, 35, 45 y 55 °C. Para el estudio del efecto de sales sobre el crecimiento microbiano, se utilizaron las siguientes concentraciones 0, 1, 2, 5 y 10% (p/v) de NaCl.
Producción de metabolitos y enzimas
La capacidad enzimática y/o producción de metabolitos se evaluó mediante pruebas bioquímicas, por lo que se emplearon los medios de cultivo: Agar de hierro y triple azúcar (TSI), Agar de hierro y lisina (LIA), Citrato de Simmons, Sal y manitol, Agar de hierro de Kligler y ureasa. Los medios se prepararon según las indicaciones de los fabricantes y se esterilizaron a 121 °C/ 15 lb durante 15 min. Se inoculó por punción con colonias del cultivo puro y se incubaron a 37°C por 24 a 72 h. Además, se utilizaron diferentes fuentes de carbono (glucosa, sacarosa, maltosa, glicerol y lactosa). Se agregó en tubos de ensaye medio de cultivo con la respectiva fuente de carbono y se esterilizaron a 121 °C/ 15 lb/ 15 min; se inoculó cada tubo con la cepa y se incubó a 37 °C durante 72 h.
Determinación de ácidos orgánicos por HPLC
El análisis cromatográfico para la determinación de ácidos orgánicos se realizó utilizando un sistema HPLC serie 168 de Beckman y Coulter, acoplado con un detector UV/Vis (PDA 190-600 nm) (Beckman y Coulter; Fullerton, Brea, CA, EE. UU.). La separación cromatográfica se realizó con una columna 7981 Jones Chromatography (BioRad, Hercules, CA, USA), empleando como eluyente una disolución de H2SO4 0.005 M con un caudal de flujo de 0.07 mL min−1 y en el horno se utilizó una temperatura de 60 °C. La detección se realizó con un detector IR (Knaur, Berlin, Alemania). Se realizó una curva de calibración antes de medir las muestras, para lo cual se prepararon soluciones estándar que contenían ácidos orgánicos, como, el ácido cítrico, tartárico, málico, succínico, láctico, pirúvico, isocítrico y alfa-cetoglutárico. Éstos se prepararon disolviendo la cantidad requerida de cada estándar en agua desionizada. Las curvas de calibración se obtuvieron trazando el área del pico (mV/min) contra la cantidad inyectada (rango cubierto 0.05 - 0.5 g L−1). Se inyectaron 20 µL de las soluciones de los estándares en la columna y se determinaron los tiempos de retención. Antes del análisis de las muestras por HPLC, éstas fueron centrifugadas a 13 000 rpm durante 10 min para eliminar las células, después fueron diluidas para ser compatibles con las soluciones estándar preparadas; posteriormente, las muestras se filtraron a través de un filtro de nailon de 0.2 µm (Whatman). Después de la inyección de las muestras, éstas se identificaron por comparación de los tiempos de retención de los picos desconocidos con el de las sustancias patrón de los distintos ácidos.
Caracterización molecular por PCR
Se realizó la extracción del ADN con el kit comercial Promega DNA Isolation and Purification, por lo que se siguieron las instrucciones del fabricante. Se realizó la amplificación del gen 16S ARNr mediante la reacción en cadena de la polimerasa (PCR). La secuenciación de DNA para la identificación molecular de la cepa se llevó a cabo mediante un servicio externo (BIOPREMIER, PORTUGAL), empleando los oligonucleótidos universales para Bacteria y Archaea 16SS (foward) (5’-AGA GTT TGA TCC TGG CTC AG-3’) y 16SR (reverse) (5’- CGG GAA CGT ATT CAC CG-3’).
Electroforesis 1D SDS-PAGE
Para la separación y detección de proteínas se realizó la electroforesis en gel de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE) en el sistema Bio-Rad, utilizando un gel separador al 12% (p/v) (1.5 M Tris-HCl, pH 8.8, 10% SDS, 40% acrilamida, 2% Bis-acrilamida), y un gel concentrador al 4% (p/v) (0.5 M Tris-HCl, pH 6.8, 10% SDS, 40% acrilamida, 2% Bis-acrilamida). Para la preparación de la muestra se mezclaron 16 µL de muestra con 4 µL del buffer de muestra 5X (Tris-HCl 1 M, pH 6.8, glicerol 50%, SDS 10%, β- mercaptoetanol 10%, azul de bromofenol 0.05%); después, se calentó la mezcla a 100 °C durante 5 min y se agregaron 15 µL en el gel. También, se agregaron 2.5 µL del marcador de peso molecular de proteínas sin teñir (Thermo Scientific). Posteriormente, se corrió el gel en 500 mL del buffer de corrida 1X (pH 8.3), recién preparado, a 15 mA por 30 min. La tinción del gel se realizó con nitrato de plata de acuerdo a la técnica descrita por Kumar (2018); además, de una búsqueda de enzimas de interés biotecnológico.
Diseño experimental
Se utilizó un diseño completamente al azar. Los datos se sometieron a un análisis de varianza (ANOVA) con cuatro repeticiones y para un nivel de significancia al 5%. Los valores informados son el promedio de las mediciones y se compararon utilizando la prueba de rango múltiple de Tukey (α = 0.05) para obtener un intervalo de confianza de 95%, utilizando STATISTICA versión 7 para Windows 8.
Resultados
En la Tabla 1 se presentan las características fenotípicas de la cepa pura aislada de la Poza del Centro de Cuatrociénegas a una temperatura de incubación de 20 °C, la cual presentó una morfología celular de Bacilo corto, Gram +; la morfología de las colonias presentaron un tamaño de 2 mm, con borde redondeado, superficie plana, forma circular y pigmentación amarilla. Se determinó la temperatura óptima de crecimiento a los 35 °C, pH óptimo de 6 y crecimiento óptimo a concentración de 2% de NaCl. Las pruebas bioquímicas realizadas indicaron que presentó la capacidad de producir ácido a partir de glucosa y sacarosa, pero no produjo gas ni ácido sulfhídrico; con respuesta positiva para la producción de la enzima lisina descarboxilasa; con capacidad de fermentar citrato, lo que indica la producción de citratasa o citrato desmolasa; en medio de cultivo sal y manitol, fermentó el manitol y presentó crecimiento a una concentración de sales de 7.5%. También presentó la capacidad de metabolizar glucosa, pero no lactosa; y no presentó la capacidad de hidrolizar la urea mediante la producción de ureasa. Además, presentó crecimiento con carbono glucosa, sacarosa, maltosa y glicerol, no presentó crecimiento al usar lactosa como fuente de carbono, por lo que no puede degradar esta fuente de carbono.
Tabla 1 Características fenotípicas de la cepa aislada de la Poza del Centro de Cuatrociénegas.
| Morfología | Fisiología | Bioquímica | Nutricional |
|---|---|---|---|
| Bacilos | T óptima 35 °C | TSI + | Glucosa + |
| Gram + | pH óptimo 6 | LIA + | Sacarosa + |
| Colonia redonda | % de sales óptimo 2% | Citrato de Simmons + | Maltosa + |
| Pigmentación amarilla | Kligler - | Glicerol + | |
| Ureasa - | Lactosa - |
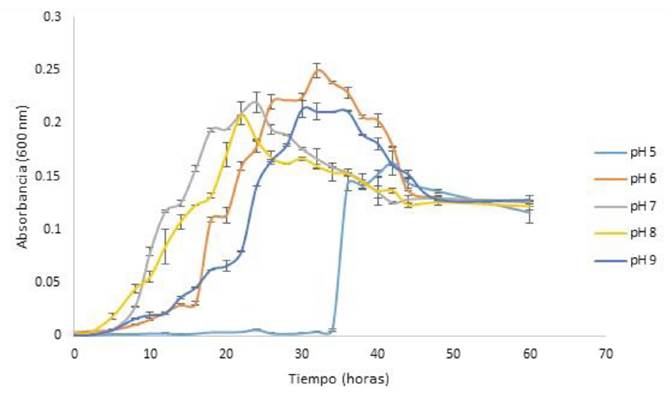
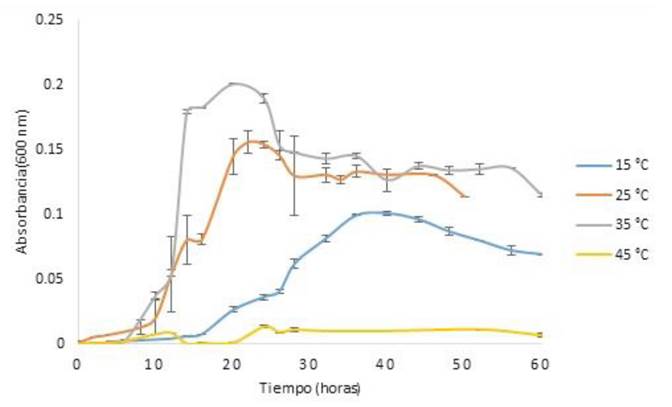
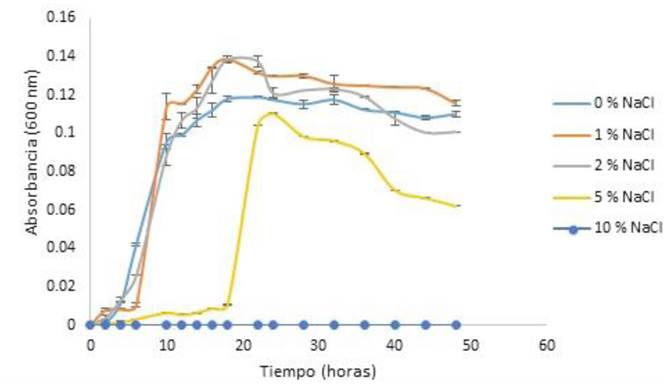
Para determinar los rangos de pH y el pH óptimo de crecimiento de la cepa se realizó una cinética de crecimiento celular. En la Figura 1 se muestra el efecto de diferentes valores de pH sobre el crecimiento bacteriano, a temperatura de incubación de 20 °C. Se pueden observar las diferentes fases del crecimiento celular; a pH 5 se tuvo una fase lag más larga, en comparación con las fases de adaptación a pH de 6 a 9. El mayor crecimiento celular se observó a pH 6. En la Figura 2 se muestra el efecto de la temperatura sobre el crecimiento celular de la cepa. Se puede observar en la cinética de crecimiento microbiano las diferentes fases de crecimiento que presentó la cepa a 15, 25 y 35 °C. A los 45 °C no se presentó crecimiento significativo, por lo que, debido a este comportamiento no se probó la temperatura de 55 °C. El mayor crecimiento celular que se obtuvo fue a 35 °C. La Figura 3 muestra el efecto de diferentes concentraciones de NaCl sobre el crecimiento de la cepa a pH 6 a temperatura de incubación de 35 °C. Se puede observar que la cepa presentó una fase de latencia corta a 0, 1 y 2%, el mayor crecimiento celular se obtuvo con 2% de NaCl; a 5% de NaCl se presentó una fase de adaptación más larga; a 10% de NaCl no se presentó crecimiento. Por lo que, clasificarse como halófilo tolerante, debido a que presentó un óptimo de crecimiento a concentraciones de sales de 2% y también presentó crecimiento a 5% de NaCl.
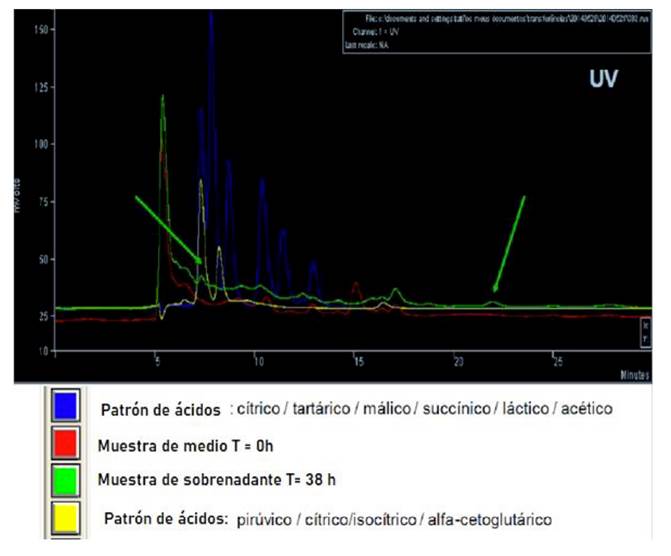
Los picos cromatográficos de los ácidos orgánicos se identificaron comparando los tiempos de retención de la muestra de la cepa con los estándares de ácido cítrico, tartárico, málico, succínico, láctico, pirúvico, isocítrico y alfa-cetoglutárico. En la Figura 4 se muestra el cromatograma obtenido del análisis por HPLC con un detector UV, en donde se puede observar en color rojo la muestra con medio al tiempo 0; en verde la muestra del sobrenadante a las 38 h de incubación, y en azul y amarillo los estándares de ácidos orgánicos. En el cromatograma se muestran dos señales que se presentaron en la muestra con el sobrenadante a las 38 h, el primero de ellos con un tiempo de retención de 7 min, el cual corresponde con los estándares de ácido pirúvico y/o ácido cítrico; y el último en eluir presentó una señal a los 22 min; sin embargo, la señal no se ajustó a los estándares usados. Los resultados del análisis de identificación molecular de la cepa mediante la secuenciación del DNA indicaron que corresponde a la especie: Microbacterium paraoxydans.
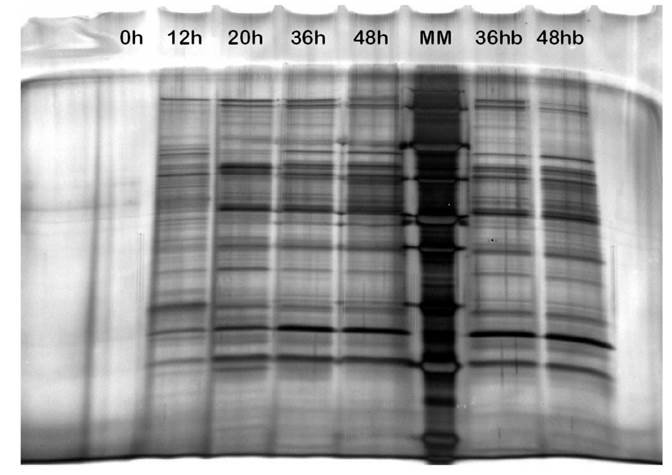
A partir de la biomasa de la cepa de M. paraoxydans, separada por centrifugación y conservada a -20 °C, se obtuvo el extracto crudo de proteínas totales, el cual fue analizado mediante electroforesis en gel de poliacrilamida en el sistema BioRad. En la Figura 5 se presenta el gel de electroforesis de proteínas totales de M. paraoxydans teñido con nitrato de plata. En el gel se pueden observar diferentes carriles, los cuales corresponden a los tiempos de incubación; 0 h (carril 1), 12 h (carril 2), 20 h (carril 3), 36 h (carril 4) y 48 h (carril 5); los tiempos 36 y 48 h se presentaron por duplicado, carril 7 y 8, respectivamente. El marcador estándar de alto peso molecular se muestra en el carril 6 (MM). También, se puede observar a partir de las 12 h de incubación un perfil complejo de proteínas totales de esta bacteria; aunque, las bandas proteícas se observan con mayor intensidad a partir de las 20 h hasta las 48 h de incubación, con pesos moleculares de aproximadamente 20, 25, 35, 40, 50, 65, 78, 100, 110, 140 y 250 kDa.
Discusión
Microbacterium paraoxydans pertenece al Phylum: Actinobacteria, orden: Micrococcales, familia: Microbacteriaceae, género: Microbacterium (Bacterial Diversity Metadatabase). Al comparar los resultados obtenidos con otros estudios, se encontró similitud con la descripción de las características fenotípicas de la bacteria. En la actualidad, el género Microbacterium comprende más de 80 especies, las cuales prestan pigmentación amarilla y son bacilos Gram + (Yi et al. 2020). Al respecto Mishra et al. (2021) describen a M. paraoxydans como un bacilo corineforme, Gram +, con diámetro de 2 mm, que crece aeróbicamente, lo que concuerda con la caracterización morfológica obtenida. La pigmentación amarilla que presentó M. paraoxydans se debe a la presencia de compuestos lipídicos, conocidos como carotenoides, que se encuentran en la membrana celular de bacterias no fotosintéticas (Merino et al. 2019), lo que concuerda con un estudio que identificó a M. paraoxydans como una bacteria no fofosintética y buena productora de pigmentos carotenoides con actividad anticancerígena y antioxidante (Ojha et al. 2017). Estos pigmentos actúan como agentes fotoprotectores contra la luz visible y la extrema exposición contra rayos UV (Meddeb-Mouelhi et al. 2016), convirtiendo la energía dañina en calor antes de que alcance las partes sensibles dentro de la célula (Musa y Yusof 2019). Además, la síntesis de osmolitos, como el inositol y glicinabetaína, también pueden contribuir a la resistencia a la radiación ultravioleta en ciertas especies del género Microbacterium (Mandakovic et al. 2020). En cuanto a la caracterización fisiológica se determinó que M. paraoxydans presentó una gran capacidad de adaptación y crecimiento en valores de pH desde 5 hasta 9, con pH óptimo de 6; pero también se ha reportado que presenta crecimiento a pH 10 (Mishra et al. 2021). Un mecanismo en el manejo del estrés ácido y alcalino de regulación del pH intracelular para mantenerlo cercano a la neutralidad, es el intercambio directo de protones con el ambiente externo mediante mecanismos de bomba de protones (Cabrera y Blamey 2018). Además, las bacterias alcalófilas tienen en su pared celular enzimas (Poli et al. 2017) y polímeros cargados negativamente, los cuales pueden reducir la densidad de la carga en la superficie de la célula y estabilizar la membrana celular (Cabrera y Blamey 2018). En tanto que M. paraoxydans creció a temperaturas de 15, 25, y 35 °C, pero no presentó crecimiento a los 45 °C, lo que difiere de lo reportado que crece a 40 y 42 °C (Mishra et al. 2021). Por lo que puede considerarse como mesófilo, debido a que su óptimo crecimiento se encuentra entre los 25 y 40 °C (Merino et al. 2019). Esto puede ser debido a la adaptación de la bacteria con la temperatura del hábitat de donde se aisló, La Poza del Centro, la cual presentó una temperatura in situ de 24 °C. En cuanto a la concentración de sales, M. paraoxydans presentó crecimiento a concentraciones de 0 hasta 5% de NaCl; se ha reportado que crece a una concentración de NaCl al 7% (Mishra et al. 2021), lo que con cuerda con el crecimiento que se obtuvo en el medio sal y manitol (7.5% NaCl). También ha sido clasificada como halófila moderada (Ojha et al. 2017). Pero de acuerdo con los resultados obtenidos puede ser considerada como halotolerante, ya que estos microorganismos son capaces de crecer en ausencia de sal, pero son tolerantes a concentraciones variables (Merino et al. 2019). La principal estrategia de adaptación de los halófilos se basa en la acumulación masiva de compuestos en el citoplasma para compensar la presión osmótica del medio exterior (Poli et al. 2017), como sales inorgánicas (sodio o potasio) o compuestos orgánicos como derivados de azúcares, glicerol, prolina y derivados (Poli et al. 2017). Además, las enzimas de los halófilos se adaptan al crecimiento en diferentes concentraciones de sal debido a cambios de los ácidos grasos en los lípidos de la membrana (Merino et al. 2019).
Los resultados de las pruebas bioquímicas indicaron que M. paraoxydans fermenta glucosa, sacarosa y manitol, no produce gas ni ácido sulfhídrico; pero tiene producción positiva de la enzima lisina descarboxilasa y negativa para ureasa, lo que concuerda con lo reportado por Mishra et al. (2021); también fermenta maltosa, galactosa, fructosa y manosa. Los microorganismos fermentadores de azúcares acidifican el medio, por lo que en el medio lisina hierro, el ambiente ácido favorece la actividad enzimática descarboxilasa y se metaboliza la lisina a cadaverina (Duhan et al. 2020). La cadeverina se emplea como intermediario en la producción de poliamidas. Actualmente, existe un creciente interés por la bioproducción de cadaverina utilizando lisina descarboxilasa como biocatalizador, ya que es más amigable con el medio ambiente y altamente eficiente, en comparación con la síntesis química a partir de recursos fósiles (Gao et al. 2022). Cabe mencionar que la descarboxilasa de los aminoácidos lisina, ornitina y arginina, desempeña un papel importante en el mecanismo de respuesta para manejar el estrés ácido y la supervivencia de las bacterias. Por lo que se sugiere que, tanto las reacciones de descarboxilación y el intercambio de protones pueden representar una estrategia metabólica para la supervivencia de la bacteria en ambientes extremos, así como para tolerar un amplio rango de pH (Mandakovic et al. 2020). Además, M. paraoxydans presentó crecimiento al utilizar como fuente de carbono glucosa, sacarosa, maltosa y glicerol. Al utilizar la maltosa como fuente de carbono, esta cepa puede presentar la maquinaria enzimática para catalizar la hidrólisis de la maltosa para producir glucosa, a través de la enzima maltasa, que pertenece a la familia de las α-glucosidasas (Tian et al. 2021). Se ha reportado que M. paraxydans presenta la actividad α-glucosidasa en la síntesis de un hexil-α-glucósido y un α-poliglucósido, los cuales tienen aplicaciones en la industria de los alimentos, cosméticos, detergentes y farmacéuticos (Ojha et al. 2013). El glicerol pude usarse para la síntesis de lípidos, y viceversa, los lípidos pueden degradarse en ácidos graos y glicerol. Los lípidos son degradados primero por las lipasas y los glicerofosfodiésteres resultantes se transportan al interior de la célula y libera glicerol-3-fosfato (Blötz y Stülke 2017). Estas enzimass son utilizados en la producción de plásticos biodegradables, área textil, aditivos alimenticios, producción de biocombustibles, medicina y agricultura (De-Avila-Montiel et al. 2016). Se ha reportado que M. paraoxydans presenta el potencial para producir enzimas como amilasa, lipasa y proteasa (Akbulut et al. 2022), con aplicaciones biotecnológicas en industrias como la alimentaria, de detergentes, farmacéutica, así como para la producción de biodisel (Cabrera y Blamey 2018).
En el cromatograma, la señal que se mostró a los 22 min puede corresponder a un carotenoide, ya que se ha reportado que la cepa Microbacterium sp. sintetiza pigmentos carotenoides con tiempos de retención de 18.6 a 23.6 min (Mandakovic et al. 2020). Por otra parte, los ácidos orgánicos son productos naturales o intermediarios en las principales vías del metabolismo de los microorganismos (Nuryana et al. 2019). El ácido pirúvico (piruvato a pH neutro) es el producto final de la glucólisis. Las reacciones que se llevan a cabo en la glucólisis son catalizadas por diversas enzimas. Además, las células utilizan el piruvato como materia prima para sintetizar moléculas más complejas, como aminoácidos y ácidos grasos, que son necesarias para mantener sus funciones vitales, para su crecimiento y reproducción (Maleki y Eiteman 2017). El ácido cítrico es un producto metabólico primario formado en el ciclo del ácido tricarboxílico (TCA), ciclo de Krebs o ciclo del ácido cítrico. El acetil CoA es el principal precursor del ciclo, el cual es producido por la oxidación del piruvato y derivado de la glucosa, como materia prima. La producción microbiana de ácido cítrico ocurre mediante la catálisis de enzimas (Khan et al. 2017). El uso de procesos biológicos para la producción de ácidos orgánicos tiene un gran potencial en diversas aplicaciones industriales, como materias primas para complementos alimenticios, como aditivos y excipientes farmacéuticos y cosméticos (Khan et al. 2017); ya que son moléculas totalmente degradables y pueden utilizarse en la producción de polímeros biodegradables, reemplazando a los productos químicos sintéticos o a los derivados del petróleo (Nuryana et al. 2019).
En el gel de electroforesis 1D SDS-PAGE se presentaron bandas con diferentes pesos moleculares, las cuales pueden corresponder a enzimas que desempeñan un papel importante en el metabolismo de la glucólisis, ya que el medio de cultivo contenía glucosa como fuente de carbono. Algunas de las enzimas que participan en la vía de la glucólisis son adelinato quinasa (22 kDa) (UniProt 2021), triosa fosfato isomerasa (26 kDa) (Matsumoto et al. 2019), hexoquinasa (35 kDa) (Meurer et al. 2016), enolasa (47 kDa) (Ji et al. 2016), fosfoenolpiruvato carboxilasa (102.8 kDa) (UniProt 2017); las cuales tienen potencial para aplicarse en áreas de la salud (Klepinin et al. 2020), en la industria farmacéutica (Kulkarni et al. 2017, Qian et al. 2017) y en la agricultura (Liu et al. 2021). Sin embargo, hacen falta más estudios para la identificación de cada una de estas bandas proteícas.
Algunas otras enzimas reportadas en estudios que se encuentran presentes en M. paraoxydans son fitoeno desaturasa (56.74 kDa) y licopeno ciclasa (12.5 kDa) (UniProt, 2017), que participan en la biosíntesis de compuestos carotenoides (Ojha et al. 2017). Además, se ha reportado que M. paraoxydans presenta enzimas celulolíticas tolerantes a pH extremo (pH 10), lo cual tiene un uso potencial en la industria del papel, de los biocombustibles y como aditivos en detergentes.
Conclusiones
Se representa el primer estudio de aislamiento y caracterización fisiológica, molecular y enzimàtica de la especie Microbacterium paraoxydans, aislada de la Poza del Centro Cuatrociénegas. M. paraoxydans presentó capacidad de crecimiento y adaptación en un amplio rango de pH y concentraciones de sales de hasta 7.5%, por lo que se considera como un microorganismo halotolerante. Además, por su capacidad de adaptación y supervivencia en varias condiciones extremas a la vez, se puede clasificar como un microorganismo poliextremófilo. De acuerdo a sus capacidades metabólicas y enzimáticas M. paraoxydans tiene el potencial para su aplicación en la producción de bioplásticos, producción de biodisel, agricultura, industria de alimentos, de detergentes y biorremediación. La diversidad microbiana del valle de Cuatrociénegas tiene el potencial para el descubrimiento de nuevos microorganismos de interés no solo biotecnológico, sino también para la astrobiología, ya que es un ambiente considerado análogo a Marte.











 nueva página del texto (beta)
nueva página del texto (beta)