Introducción
La Acalasia es un desorden motor esofágico de etiología desconocida, incurable caracterizada manométricamente por una relajación incompleta del esfínter esofágico inferior (EEI) y pérdida de la peristalsis esofágica; radiológicamente por aperistalsis, dilatación esofágica con mínima apertura del EEI, apariencia de ‘pico de ave’ y pobre vaciamiento de bario; endoscópicamente con saliva retenida, líquido y partículas de comida no digeridas en ausencia de estenosis o tumoraciones1.
Descripciones de Acalasia datan de la Edad Media cuando huesos de ballena eran usados como método para dilatar y resolver síntomas2. En 1672 Sir Thomas Willis describió por primera vez ‘vómito’ persistente en un paciente por lo que desarrollo la primera dilatación mecánica usando huesos de ballena, desde entonces la técnica ha evolucionado hasta usar balones neumáticos que son posicionados e inflados guiados con un fluorosocopio3. En 1913 Ernest Heller desarrolló la primera miotomía quirúrgica empleando miotomía dual anterior y posterior, esta técnica posteriormente fue refinada hasta la técnica estándar actual: miotomía anterior laparoscópica a través de la unión esofagogástrica (UEG) hasta la pared gástrica con funduplicatura parcial para reducir el riesgo de enfermedad por reflujo gastroesofágico (ERGE)4.
La Acalasia ocurre de forma equiparable en hombres y mujeres, con una incidencia de 1 en 100,000 individuos anualmente y una prevalencia de 10 en 100, 000. No existe predilección racial. El pico de incidencia ocurre entre los 30 y 60 años de edad5,6.
Fisiopatología
La fisiopatología de las alteraciones resulta del daño a la inervación del segmento de músculo liso del esófago (incluido el EEI). Se han propuesto cambios neuroanatómicos responsables que incluyen perdida de las células ganglionares del plexo mientérico (Auerbach), degeneración del nervio vago y degeneración del núcleo motor dorsal del vago. De estas posibilidades, solo la pérdida de células ganglionares está bien sustentada. El grado de pérdida de células ganglionares es paralela a la duración de la enfermedad, por lo que están prácticamente ausentes con enfermedad por más de 10 años. La principal causa de degeneración ganglionar se atribuye principalmente a un proceso autoinmune por infección latente del virus herpes simple tipo 1 (VHS-1) en individuos genéticamente susceptibles. En el análisis inmunohistoquímico del plexo mientérico de estos pacientes, se muestran células inflamatorias en reposo o células citotóxicas T activadas. El disparador principal de esta respuesta autoinmune sugiere una infección viral crónica o latente. Anticuerpos anti VHS-1 y ADN del mismo han sido aislados en 84-63% de los casos7.
Tabla 1 Comparación entre grupos.
| Ambos grupos | Anterior | Posterior | Valor p | |
|---|---|---|---|---|
| Número de pacientes n (%) | 51 | 29 (56.9) | 22 (43.1) | |
| Tiempo promedio (minutos) | 62.3 | 60.3 | 64.9 | 0.348 |
| Eventos adversos n (%) | 16 (31.4) | 9 (31) | 7 (31.8) | 0.594 |
| Enfisema subcutáneo | 11 (21.6) | 4 (13.8) | 7 (31.8) | 0.114 |
| Micro perforaciones | 4 (7.8) | 3 (10.3) | 1 (4.5) | 0.417 |
| Respuesta clínica (%) | 46 (90.2) | 26(89.7) | 20 (90.9) | 0.632 |
| Respuesta manométrica (%) | 46 (90.2) | 25 (86.2) | 21 (95.5) | 0.273 |
| Esofagitis n (%) | 15 (29.4) | 9 (31) | 6 (27.3) | 0.510 |
| Demeester (%) | 33.3 | 27.6 | 40.9 | 0.242 |
| Síntomas de reflujo n (%) | 7 (13.7) | 4 (13.8) | 3 (13.6) | 0.657 |
La disfunción motora se sugiere por denervación posganglionar del músculo liso esofágico. Dicho daño puede potencialmente afectar neuronas ganglionares excitatorias (colinérgicas), neuronas ganglionares inhibitorias (óxido nítrico, péptido intestinal vaso activo) o ambas8.
Manifestaciones clínicas
Los síntomas de este desorden motor son la presencia de disfagia a sólidos y líquidos asociada a regurgitación de comida mal digerida y saliva. Dolor retroesternal durante comidas, pérdida de peso y pirosis pueden ser síntomas acompañantes que en ocasiones pueden mal diagnosticarla como ERGE9. Por lo que es importante reconocer la necesidad de evaluación (endoscopia, monitorización del reflujo y manometría) cuando la terapia antirreflujo adecuada no mejora los síntomas10.
El uso de cuestionarios estandarizados en el entorno clínico es limitada, se debe utilizar una evaluación clínica exhaustiva de los síntomas esofágicos antes y después de la terapia para evaluar el éxito del tratamiento10.
Tabla 1 Sistema de puntaje clínico para Acalasia (Puntaje de Eckardt)
| Puntaje | Síntomas | |||
|---|---|---|---|---|
| Pérdida de peso (kg) | Disfagia | Dolor retroesternal | Regurgitación | |
| 0 | Ninguno | Ninguno | Ninguno | Ninguno |
| 1 | <5 | Ocasional | Ocasional | Ocasional |
| 2 | 5-10 | Diario | Diario | Diario |
| 3 | >10 | Cada comida | Cada comida | Cada comida |
En cuanto a la morbilidad, en estos pacientes, se ha encontrado que el cáncer esofágico es más común en el grupo de pacientes con Acalasia comparado con grupos controles con un riesgo relativo de 5.22 (95% CI 1.88 a 14.45). La mediana de tiempo para el diagnóstico de cáncer esofágico fue de 15.5 (IQR 5.8-26.2) años. Otra patología asociada es la neumonía por aspiración con un RR 13.4 (CI 1.7 a 107.8)11.
Manometría esofágica
Es la técnica ‘gold standard’ para evaluar la motilidad esofágica. Desde que se inventó el primer concepto en la década de 1950, las modificaciones técnicas continuas han mejorado las técnicas de medición. En la década de 1990, se introdujo la manometría de alta resolución (MAR), que tenía un mayor número de sensores de presión, lo que disminuía el espacio entre los sensores respectivos a intervalos de 1 cm. Los pioneros fueron Ray Clouse y Geoff Hebbard12. Esto hizo posible medir el patrón de presión a lo largo de todo el esófago con cada trago, desde el esfínter esofágico superior (UES) hasta el LES, proporcionando una representación completa de la función motora esofágica. Como resultado, las grabaciones de manometría podrían mostrarse a partir de entonces como un gráfico de presión continua en el que la amplitud de presión se expresa como colores de manera similar a un mapa de altitud. En estos llamados gráficos de topografía de presión esofágica (TPE), con el tiempo en el eje xy la posición esofágica en el eje y, los colores más cálidos representan presiones altas y los colores más fríos representan presiones bajas13.
Era inevitable que la introducción de TPE condujera a nuevas métricas y parámetros. Esto fortaleció la necesidad de reevaluar el esquema de clasificación, que fue desarrollado originalmente para mediciones de manometría convencionales14. En 2008, el primer sistema oficial de clasificación para TPE, la clasificación de Chicago, se desarrolló después de varios estudios en voluntarios y pacientes sanos15. A la segunda versión se publicó en 2012, que se actualizó por última vez en 201516. La implementación de MAR es una mejora importante en comparación con la manometría convencional17.
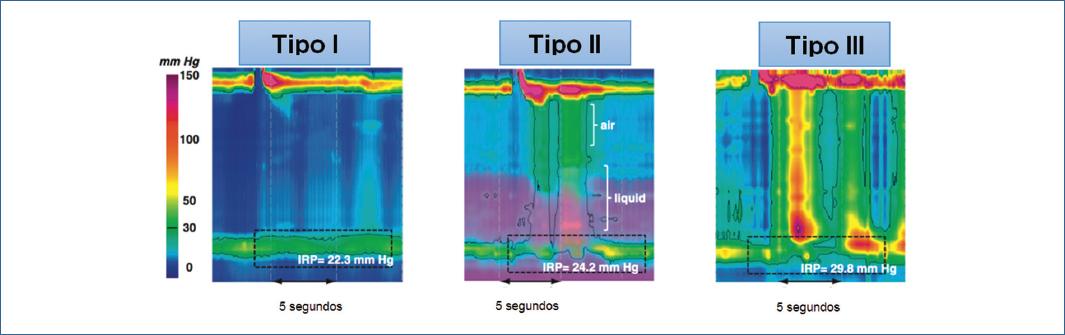
De acuerdo a la clasificación de Chicago V3.0, existen tres subtipos clínicamente relevantes de Acalasia definidos mediante manometría de alta resolución (MAR):
– Acalasia tipo I: Caracterizada por 100% de contracciones fallidas y una presión de relajación integrada (IRP) mayor a 15.
– Acalasia tipo II (presurización panesofágica): 100% de contracciones fallidas y panpresurización esofágica en al menos 20% de los tragos e IRP>15.
– Acalasia tipo III (espástica): Contracciones prematuras en al menos 20% de los tragos e IRP >1518,19.
Esta nueva subclasificación ha demostrado ser útil en la predicción de la respuesta al tratamiento. Varios estudios muestran diferencias en la respuesta al tratamiento entre los 3 subtipos de acalasia20,21. Todos los estudios observan uniformemente la mejor respuesta al tratamiento en pacientes con acalasia tipo II y la peor respuesta en pacientes con acalasia tipo III. Los efectos del tratamiento son variables entre los 3 subtipos. Esto explica todas las diferentes modalidades de tratamiento, lo que sugiere que el subtipo de acalasia puede servir como criterio para el tratamiento óptimo en diferentes pacientes22.
Estudios contrastados
En el esofagograma de un paciente con Acalasia, encontramos un esófago dilatado, una UEG estrecha con apariencia de ‘pico de ave’, aperistalsis y pobre vaciamiento de bario. Además de ayudar en el diagnóstico, un esofagograma también es útil para evaluar los cambios en etapas tardías (tortuosidad, angulación, megaesófago) que pueden tener implicaciones para el tratamiento. Además el examen radiológico provee una evaluación objetiva del vaciamiento gástrico después de la terapia. En muchos pacientes con Acalasia los síntomas se alivian no siempre en paralelo con el vaciamiento esofágico. Mediante el esofagograma temporizado (1 y 5 minutos después de la ingesta de bolo de bario) podemos evaluar de forma objetiva si existe falla al tratamiento a pesar de mejoría sintomática inicial23.
Endoscopia
El rol de la endoscopía es descartar causas de obstrucción mecánica o pseudoacalasia que pueden simular Acalasia clínica y manométricamente. La evaluación endoscópica ante la sospecha inicial de pacientes mal diagnosticados como ERGE. Los hallazgos van desde apariencia normal hasta un esófago sigmoideo, tortuoso y dilatado con alimento retenido y secreciones, la intubación del estómago a través de la UEG suele ofrecer leve resistencia, si es mayor sospechar de pseudoacalasia. Por lo anterior, la endoscopia puede no ser sensible en un esófago no dilatado, por lo que la MAR está indicada en sospecha de Acalasia.
Endoscópicamente la mucosa en Acalasia es normal, sin embargo por estasis no es poco común encontrar cambios inflamatorios o ulceraciones por estasis, candidiasis o esofagitis por píldoras. Generalmente no es necesaria la toma de biopsias24.
Tratamiento
El tratamiento puede considerarse con el propósito de reducir los síntomas y, en consecuencia, mejorar la calidad de vida. En segundo lugar, el tratamiento podría prevenir la progresión a la enfermedad en etapa terminal y la aparición de complicaciones tardías, como la aspiración y la carcinogénesis. Sin embargo, los datos sobre la historia natural de la enfermedad para respaldar esto son escasos. Existe evidencia indirecta de que un tratamiento adecuado podría reducir el riesgo de dilatación esofágica progresiva en pacientes con acalasia, lo que podría prevenir un estado de dilatación esofágica grave, que a su vez se asocia con un mal resultado. Además de la mejoría de los síntomas, la mejora del vaciado esofágico medido objetivamente, por lo tanto, debe considerarse como un objetivo de tratamiento adicional importante25.
La miotomía quirúrgica ha sido el tratamiento de elección más confiable para tratar la acalasia esofágica desde el primer informe de Heller en 191326. Otros métodos de manejo incluyen medicamentos, dilatación con balón27,28, e inyección de toxina botulínica, que aún no son concluyentes debido a la relativa baja eficacia y también tasas de complicaciones relativamente altas29.
POEM está emergiendo como el tratamiento de elección para la acalasia e incluso se utiliza para el tratamiento previo de la acalasia fallida, incluida la miotomía quirúrgica laparoscópica30.
El concepto de cirugía endoscópica transluminal de orificio natural (NOTES) fue introducido por Kalloo y sus colegas31,32. Bajo la influencia de las demandas rápidamente crecientes de tratamiento menos invasivo, Inoue introdujo la miotomía endoscópica peroral (POEM) en humanos como método de tratamiento no quirúrgico para la acalasia esofágica en 2010. Desde entonces, POEM ha sido uno de los tratamientos estándar para tratar la acalasia esofágica y las enfermedades relacionadas con la motilidad esofágica, como el espasmo esofágico difuso y el esófago martillo neumático33,34.
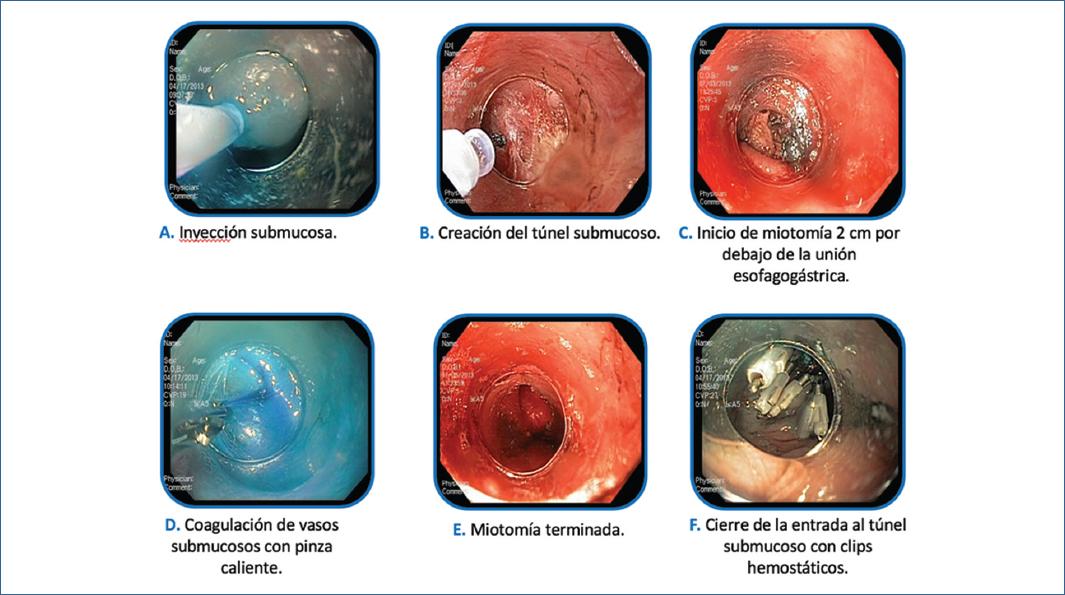
La técnica POEM (Imagen 2):
Aproximadamente 10 ml de solución salina suplementada con 0.3% de índigo carmín se inyecta en el espacio submucoso en la pared anterior (11-2 horas) o posterior (5 horas) del esófago medio. Posteriormente, se realiza una incisión longitudinal de la mucosa de 2 cm como entrada de la mucosa en el espacio submucoso (el modo de corte en seco [50 W, efecto 3] o el modo Endocut I). Luego, se utiliza una técnica similar a la disección submucosa endoscópica para crear un túnel submucoso de aproximadamente 2 o 3 cm hacia el estómago proximal. El modo de coagulación por pulverización (40-60 W, efecto 1-2) se utiliza para diseccionar la capa submucosa. Los vasos más grandes en la submucosa se coagulan utilizando las pinzas en el modo de coagulación suave (80 W, efecto 5). La determinación de la posición anterior (11-2 horas) o posterior (5 horas) del túnel submucoso y miotomía depende de la preferencia del operador. Aunque hay poca evidencia, muchos expertos sugieren que la miotomía posterior puede tener una ventaja para el alivio de la disfagia, y la miotomía anterior puede ser mejor en la prevención de la enfermedad por reflujo gastroesofágico.
La disección del haz muscular circular se inicia a 2-3 cm distales de la entrada de la mucosa usando un cuchillo de punta triangular. El músculo circular capturado se corta utilizando una corriente de coagulación en spray (40-60 W, efecto 1-2), evitando el sangrado masivo de los vasos intramusculares. La división del músculo del esfínter se continúa desde el lado proximal hacia el estómago y 2 o 3 cm en el cardias, de acuerdo con los estándares quirúrgicos de la miotomía de Heller.
Una vez completada la miotomía, se confirma la mejora del paso del endoscopio en el UEG desde el interior del túnel y la luz esofágica verdadera. La entrada incisiva de la mucosa se cierra con clips hemostáticos después de la pulverización de una solución antibiótica profiláctica dentro del túnel. El cierre completo de la entrada de la mucosa se confirma endoscópicamente35.
Resultados
La intervención es exitosa y eficaz para el manejo de los síntomas con una tasa de éxito del 82 al 100%. Los resultados de la intervención para tratar la acalasia se evalúan subjetiva y objetivamente por múltiples métodos. La herramienta más utilizada para evaluar los resultados es el puntaje de Eckardt, que es una evaluación subjetiva de los síntomas previos y posteriores a la intervención. El éxito clínico se define como una puntuación de Eckardt posterior a la intervención de 3 o inferior o una reducción de LES en un 50% o más36.
De forma objetiva, estudios previos reportan una disminución significativa en la presión del esfínter esofágico inferior y la presión de relajación integrada de 33 ± 1.7 y 30 ± 1.4 mmHg a 14 ± 1.2 (p <0.05)37.
Complicaciones
Los eventos adversos graves son poco frecuentes, pero pueden incluir mucosotomías inadvertidas, fugas cerca del UEG que requieren intervención quirúrgica urgente, neumotórax intraprocedural o neumoperitoneo, túnel intraquirúrgico o posprocedural o sangrado luminal. Sin embargo, la incidencia de estos eventos adversos más graves es <1–2%. Similar a la miotomía de Heller, se ha observado ERGE postoperatoria después de POEM38.
Seguimiento a largo plazo
La mayoría de estas series demostraron un éxito clínico sostenido de POEM en> 90% de los pacientes, con una duración de seguimiento que varía de 12 meses a más de 36 meses39. Un seguimiento posterior al procedimiento de 3 a 6 meses debe incluir EGD, manometría y un estudio de pH para evaluar el resultado del paciente y evaluar cualquier complicación40.
La tasa de reflujo después de POEM varía de 5.7% a más de 50% dependiendo de la serie (49)41. El reflujo objetivo confirmado en el estudio de endoscopia o pH se estima entre 20-46%; Estas tasas son tasas similares a la miotomía de Heller (33)42. El metaanálisis de Akintoye et al. mostraron tasas de reflujo sintomático, esofagitis en la endoscopia y exposición anormal al ácido durante 24 h de monitoreo de pH del 8,5% (IC 95%: 4,9-13%), 13% (IC 95%: 5-23%) y 47% (IC 95%: 21-74%), respectivamente43. Dos metaanálisis no encontraron diferencias estadísticamente significativas entre las tasas de reflujo después de miotomía de Heller y POEM. Sin embargo, existe una preocupación acerca de POEM y GERD debido a la ausencia de un procedimiento asociado antirreflujo en POEM en comparación con la fundoplicatura sistemática durante miotomía de Heller. Se cree que muchos pacientes asintomáticos después de POEM pueden tener una exposición al ácido anormal44.
Objetivos
– Objetivo primario. Comparar la efectividad clínica y manométrica en los pacientes sometidos a POEM así como la presencia de complicaciones en ambos abordajes (anterior y posterior) y en el seguimiento a 6 meses.
– Objetivos secundarios: Describir las características (epidemiológicas, clínicas y manométricas) de los pacientes diagnosticados con acalasia.
Material y métodos
Es un estudio retrospectivo, observacional, descriptivo, transversal. Incluimos pacientes con diagnóstico de Acalasia vírgenes a tratamiento y candidatos a POEM con abordaje anterior o posterior en el Hospital 1° de Octubre del ISSSTE en la Ciudad de México del 2016 al 2018.
– Criterios de inclusión:
Pacientes con diagnóstico confirmado de Acalasia tipo I, II y III vírgenes a tratamiento
Con endoscopia, trago de bario y manometría de alta resolución previa y post procedimiento.
Mayores de 18 años
– Criterios de exclusión:
Embarazo
Enfermedades que contraindiquen el procedimiento (cáncer, hipertensión portal, etc)
Ablación por radiofrecuencia
Coagulopatía
Rechazo al procedimiento
Tratamiento endoscópico y quirúrgico previo
Otros trastornos motores esofágicos.
Se realizó la revisión de expedientes para búsqueda de edad, sexo síntomas y puntaje de Eckardt basal. Mediante el equipo ManoScan de Given Imaging software ‘ManoView Acquisition’ buscamos el diagnóstico y tipo de acalasia (de acuerdo a la clasificación Chicago V3.0) así como valor de IRP.
En el seguimiento a 6 meses se evaluó:
La respuesta clínica mediante la clasificación de Eckardt, considerándola satisfactoria con un puntaje <3.
Respuesta manométrica mediante un estudio de control considerándola satisfactoria con una presión de relajación integral IRP <15 mm Hg.
Se realizó una endoscopia de control para determinar la presencia de esofagitis mediante la Clasificación de los Ángeles (Se considera esofagitis objetiva los grados C y D).
Presencia de síntomas de reflujo gastroesofágico mediante el cuestionario de síntomas GERD Q, considerándose positivo un puntaje >8.
Se realizó una pH-metría de 24 horas sin IBP con el sistema de monitoreo ambulatorio del pH Digitrapper mediante el software Accuview, al contar con un Demeester >14.7 y asociación de síntomas positiva diagnosticando ‘reflujo ácido patológico’.
Se utilizó estadística descriptiva; Para diferencia de proporciones entre las 2 técnicas en variables no paramétricas X2 y para variables paramétricas t de student; Se utilizó el paquete estadístico SPSS V.22 y se consideró estadísticamente significativo valor de p menor de 0.05.
Tabla 1 Comparación entre grupos
| Ambos grupos | Anterior | Posterior | Valor p | |
|---|---|---|---|---|
| Número de pacientes n (%) | 51 | 29 (56.9) | 22 (43.1) | |
| Tiempo promedio (minutos) | 62.3 | 60.3 | 64.9 | 0.348 |
| Eventos adversos n (%) | 16 (31.4) | 9 (31) | 7 (31.8) | 0.594 |
| Enfisema subcutáneo | 11 (21.6) | 4 (13.8) | 7 (31.8) | 0.114 |
| Micro perforaciones | 4 (7.8) | 3 (10.3) | 1 (4.5) | 0.417 |
| Respuesta clínica (%) | 46 (90.2) | 26(89.7) | 20 (90.9) | 0.632 |
| Respuesta manométrica (%) | 46 (90.2) | 25 (86.2) | 21 (95.5) | 0.273 |
| Esofagitis n (%) | 15 (29.4) | 9 (31) | 6 (27.3) | 0.510 |
| Demeester (%) | 33.3 | 27.6 | 40.9 | 0.242 |
| Síntomas de reflujo n (%) | 7 (13.7) | 4 (13.8) | 3 (13.6) | 0.657 |
Resultados
Se incluyeron 51 pacientes, 21 con Acalasia tipo II (41.2%); La edad promedio fue de 59.3 años (25-88 años), con 32 mujeres (62.7%). El puntaje Eckardt basal de 9, una IRP basal de 35.7 mm Hg. Del total de casos, el abordaje anterior se realizó en 29 casos (56.9%). El tiempo promedio de procedimiento fue 62.3 minutos (DE 17.01) (rango 34-118), la técnica anterior fue más rápida con 60.3 minutos (p=0.348).
En el seguimiento respuesta clínica y manométrica de 90.2% en ambos grupos, sin diferencias significativas entre abordajes. El evento adverso más frecuente fue enfisema subcutáneo en 11 pacientes (21.6%), con una tendencia mayor en abordaje posterior 31.8% (p=0.114); En 4 pacientes micro perforaciones sin diferencia entre abordajes (p=0.417) y resolvieron con manejo endoscópico. Se diagnosticó esofagitis en 15 casos (29.4%) mediante endoscopía (Clasificación de los Ángeles), pH-metría positiva por Demeester en 33.3% de los casos sin diferencias significativas entre grupos.
Discusión
La Acalasia es un trastorno motor raro de etiología desconocido, cuyas terapias son de carácter paliativo. Dentro de las nuevas alternativas, se encuentra la miotomía endoscópica per oral, la cual consiste en realizar una miotomía o túnel submucoso en la pared anterior o posterior del esófago. De forma general esta terapia tiene un éxito clínico y manométrico equiparable al estándar de oro (Miotomía de Heller), con mayor incidencia de enfermedad por reflujo gastroesofágico (ERGE). Sin embargo existe poca evidencia que compare ambas técnicas en cuanto a éxito, presencia de eventos adversos y complicaciones.
Por lo que en nuestro centro decidimos comparar dichos abordajes; El tiempo de ambos procedimientos fue equiparable, alrededor de 60 minutos, similar a otros centros internacionales. La presencia de eventos adversos en todos los casos fueron menores, de ellos, el principal, que en otras series ha dejado de ser considerado una complicación fue el enfisema subcutáneo, el segundo la presencia de perforaciones, resueltas vía endoscópica sin complicaciones.
Para determinar el éxito clínico utilizamos la Escala de Eckardt, obtuvimos un puntaje menor a 3 en el 90% de los pacientes, con ligero predominio no significativo en el abordaje anterior. La respuesta manométrica, considerada objetiva, fue de igual forma con predominio en el abordaje anterior. Una de nuestras debilidades podría considerarse que no determinamos si un tipo de Acalasia en específico responde mejor al abordaje anterior.
A los 6 meses dentro del protocolo de seguimiento, evaluamos la presencia síntomas de ERGE con el cuestionario de síntomas GERD Q con predominio en el 13% sin predominio en el abordaje. De forma protocolaria a todos los pacientes se les realizó una panendoscopia y ph-metría de 24 horas. En el caso de la endoscopia encontramos un tercio de pacientes con datos de esofagitis (A-D de la clasificación de los Ángeles). Que correlacionó con el porcentaje de pacientes encontrados en ph-metría.
Dentro de las fortalezas de nuestro estudio se encuentra el número de pacientes, al ser un centro de referencia, pudimos excluir aquellos pacientes que no cumplían con todos los criterios de inclusión para este estudio en específico. Existen limitaciones como el que sea un estudio retrospectivo, de un centro único y con solo dos operadores. Por lo que este estudio es una ventana de oportunidad para la realización de estudios prospectivos que respondan estas interrogantes.











 nueva página del texto (beta)
nueva página del texto (beta)