Introducción
La vacunación es uno de los programas más seguros y efectivos para la salud pública. Su éxito ha sido tal que varias de las enfermedades que previenen son poco conocidas por el personal de salud.
La actual pandemia de COVID-19 nos ha recordado la importancia de continuar la investigación sobre este tema; y si bien la cobertura mundial ha sido unos de los problemas más críticos, la reticencia a la inmunización es un desafío creciente en el que intervienen factores como la experiencia con los servicios de salud, los antecedentes familiares, la confianza en la ciencia y las autoridades competentes, así como las redes sociales para rechazar y demorar la aplicación de una vacuna.1
La percepción sobre la seguridad de las inmunizaciones es otro cofactor involucrado; de hecho, Ruiter et al. demostraron que una mayor apreciación de los riesgos que de los beneficios favorece el rechazo a esta intervención.2 Por tal motivo, esta revisión tiene como objetivo recordar a los médicos que las vacunas tienen efectos adversos, como cualquier otro medicamento; y en efecto, estos pueden ser mediados por un mecanismo de hipersensibilidad. Asimismo, se ahonda en su correcta clasificación y su abordaje diagnóstico. Afortunadamente la anafilaxia es un evento muy raro tras la vacunación, por lo cual los beneficios de protección contra una enfermedad mortal sobrepasan abismalmente a los riesgos de esta.
En el caso de las vacunas para el nuevo coronavirus SARS-CoV-2, se ha reportado en Estados Unidos una tasa de anafilaxia de 1:200 000 para la vacuna Pfizer-BioNTech, y de 1:360 000 para la vacuna de Moderna.3
Definiciones de anafilaxia y anafilaxia inducida por vacunas
La anafilaxia es una reacción alérgica aguda y sistémica que puede poner en riesgo la vida y se asocia con distintos mecanismos inmunológicos, factores desencadenantes y manifestaciones clínicas. Es precisamente por esta variabilidad que se han establecido criterios, los cuales permiten diagnosticarla cuando se cumple al menos uno de tres escenarios.4 (Cuadro 1).
Cuadro 1 Criterios clínicos para el diagnóstico de anafilaxia
| Criterios clínicos para el diagnóstico de anafilaxia |
|
1. Inicio agudo de la enfermedad (minutos a horas) con involucro de la piel, mucosas o ambos (urticaria generalizada prurito, eritema, edema de labios, lengua o úvula) y al menos uno de los siguientes: a) Compromiso respiratorio (disnea, sibilancias, estridor, flujo espiratorio pico reducido, hipoxemia) b) Presión arterial disminuida o síntomas asociados con disfunción orgánica (hipotonía, síncope, incontinencia) |
|
2. Dos o más de los siguientes ocurren rápidamente tras la exposición a un alérgeno probable para el paciente en cuestión: a) Involucro de piel o mucosas (urticaria generalizada, prurito, eritema, edema de labios, lengua o úvula) b) Compromiso respiratorio (disnea, sibilancias, estridor, flujo espiratorio pico reducido, hipoxemia) c) Presión arterial disminuida o síntomas asociados con disfunción orgánica (hipotonía, síncope, incontinencia) d) Síntomas gastrointestinales súbitos (dolor abdominal, vómito) |
|
3. Presión arterial disminuida tras la exposición a un alérgeno probable para el paciente en cuestión: a) Pacientes pediátricos, presión arterial sistólica baja para la edad o una disminución mayor a 30 %, con respecto de la presión arterial sistólica b) Pacientes adultos, presión arterial sistólica menor a 90 mm Hg o una disminución mayor a 30 %, con relación a su basal |
Fuente: referencia 4.
Sin embargo, desde el punto de vista operativo, y con el objetivo de establecer una referencia para los estudios de seguridad de vacunas, The Brighton Collaboration Allergic Reactions Working Group elaboró una definición que asigna tres grados de certeza, dependiendo de la combinación de criterios mayores y menores, siendo el nivel 1 el caso con la mayor certeza diagnóstica y el nivel 3 el caso con la menor certeza diagnóstica (Cuadro 2). Para mantener una especificidad suficiente, el involucro de dos o más sistemas orgánicos es indispensable en cualquier nivel de la definición, y siempre debe incluir a los sistemas cardiovascular o respiratorio. Este trabajo constituye el estándar de oro en lo que concierne a los casos de anafilaxia posteriores a la inmunización.5
Cuadro 2 Definición de un caso de anafilaxia. Criterios de Brighton
Fuente: Referencia 5.
La World Allergy Organization también propuso una definición muy amplia.6 Por su parte, el National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network elaboró una definición operacional más específica, aunque empleada principalmente para la evaluación clínica de los pacientes.7
Epidemiología de la anafilaxia a vacunas
Todas las inmunizaciones tienen el potencial de desencadenar una anafilaxia, aunque es un evento muy poco frecuente. Un estudio histórico publicado por Bohlke et al., estimó una tasa de incidencia de anafilaxia en niños y adolescentes de 0.65 (95 % IC, 0.21-1.53) casos por 1 000 000 de vacunas aplicadas.8 Un estudio poblacional más reciente que incluyó niños y adultos, identificó 33 casos de anafilaxia entre 25 173 965 dosis, es decir, 1.31 (95 % IC, 0.9-1.84) casos por 1 000 000 de vacunas aplicadas. Entre otros hallazgos se puede mencionar que las tasas fueron similares por edad, destacando que no se identificaron casos en pacientes menores de 4 años, lo que probablemente se debe a la dificultad para aplicar los criterios de Brighton en este grupo etario y al predominio de casos de mujeres comparados con hombres. Asimismo, las tasas para una inmunización en específico fueron difíciles de cuantificar, ya que la mayoría de las vacunas fueron administradas concomitantemente. Sin embargo, se encontró que la vacuna trivalente de influenza fue el principal contribuyente al total con una incidencia de 1.35 (95 % IC, 0.65-2.47) casos por 1 000 000 de vacunas aplicadas. Esto se puede explicar porque es la vacuna con el mayor número de dosis en el periodo evaluado.9 (Cuadro 3).
Cuadro 3 Incidencia de anafilaxia por tipo de vacuna
| Vacuna | Incidencia de anafilaxia |
| Vacuna que protege a los niños pequeños contra la difteria, el tétanos y la tosferina (DTaP) |
0.95 por 1 000 000 de dosis 0.36 por 100 000 dosis 2.07 por 1 000 000 de dosis |
| Influenza |
7 por 3 300 000 dosis (IIV) 0 entre 232 406 dosis (LAIV) |
| Sarampión, rubéola y parotiditis (SRP) |
0.06 por 100 000 dosis 5.14 por 1 000 000 de dosis |
| Varicela | 0 por 1 300 000 dosis |
| Fiebre amarilla | 0.42 a 1.8 por 100 000 dosis |
| Meningocócica conjugada (Men ACWY) | 7 casos sospechosos entre 8 200 000 dosis |
| Virus de papiloma humano (VPH) | 2.6 por 100 000 dosis |
Fuente: referencia 67.
En una revisión de 2016, la World Allergy Organization reportó una tasa estimada de anafilaxia a vacunas de entre uno en 100 000 a uno en 1 000 000.10 Este cálculo es complejo, ya que un gran número de reacciones no es registrado o se obtiene a partir de una encuesta. En el caso de México, la anafilaxia está comprendida dentro de los eventos presuntamente atribuibles a la vacunación o inmunización (ESAVI) de tipo grave, que generalmente se limitan a una presentación dentro de los primeros 30 días posteriores a la inmunización. De 2014 a 2019, se notificaron 13 365 eventos, de los cuales 10.2 % (1337) se catalogaron como graves; siendo las principalmente involucradas las vacunas contra la influenza, la vacuna contra la tuberculosis (BCG), la vacuna contra la difteria, el tétanos, la tosferina, la poliomelitis, el Haemophilus influenzae tipo B y la hepatitis B (hexavalente) y la vacuna contra la difteria, la tosferina y el tétanos (DPT).11
Fisiopatología de las reacciones de hipersensibilidad inducidas por vacunas
Las reacciones de hipersensibilidad inducidas por vacunas pueden explicarse por los mecanismos fisiopatológicos que se detallan a continuación:12 (Figura 1)
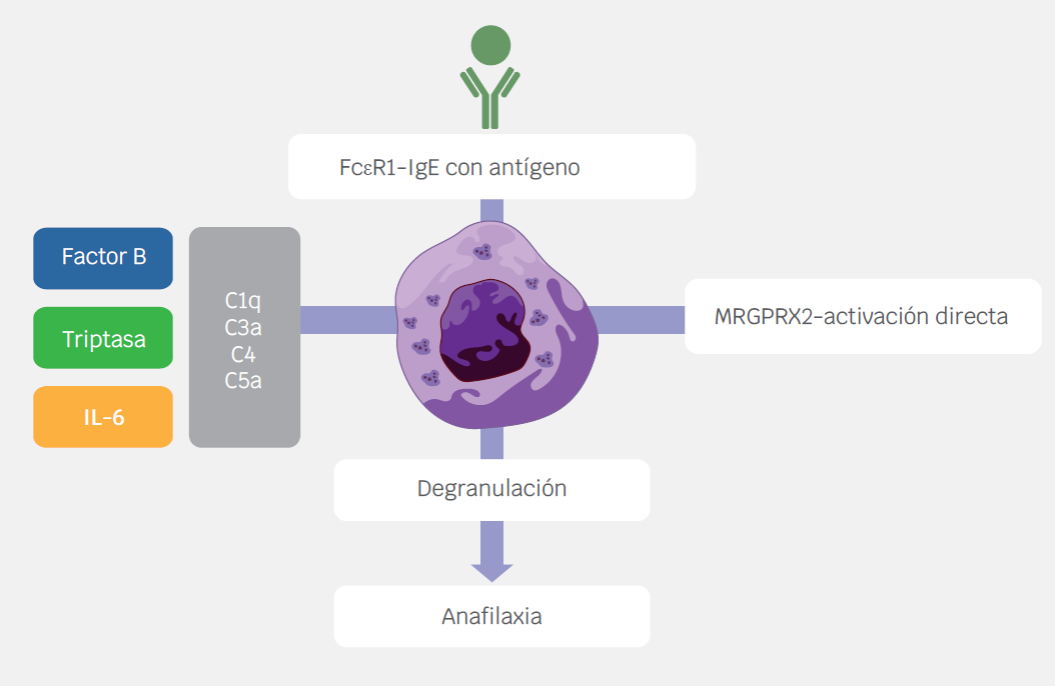
Figura 1 Las reacciones de hipersensibilidad inducidas por vacunas pueden explicarse por los siguientes mecanismos fisiopatológicos: a) Activación y degranulación de los mastocitos por el entrecruzamiento del receptor FcERI mediado por el complejo IgE/antígeno. b) Pseudoalergia relacionada con la activación del complemento (CARPA). c) Activación directa de los mastocitos mediante la activación del receptor MRGPRX2 (Mas-related G protein-coupled receptor X2). El primero corresponde a una reacción de hipersensibilidad alérgica, mientras que los dos últimos explican las respuestas de hipersensibilidad no alérgicas. Referencia 12.
Activación y degranulación de los mastocitos por el entrecruzamiento del receptor FcERI mediado por el complejo IgE/antígeno. Representa la reacción de hipersensibilidad tipo I de Gell y Coombs, en la cual los anticuerpos IgE producidos como respuesta a los antígenos, excipientes o proteínas residuales de las vacunas, se unen entrecruzadamente al receptor FcεRI localizado en los mastocitos y basófilos provocando la activación de estas células, y por lo tanto la liberación del contenido de sus mediadores preformados. Usualmente las manifestaciones clínicas se presentan dentro de los primeros minutos hasta cuatro horas después de la exposición al agente responsable.13,14
Pseudoalergia relacionada con la activación del complemento (CARPA, por sus siglas en inglés). El cuadro clínico dado por este mecanismo es indistinguible de una reacción de hipersensibilidad tipo I; sin embargo, cabe destacar dos aspectos, que IgE no participa en la liberación de los mediadores preformados y que puede darse aún con la primera exposición al agente en cuestión, es decir, no hay fases de sensibilización ni efectora.15 Resumidamente, el desencadenante activa la cascada del complemento tras adherirse a anticuerpos IgG e IgM, con la consecuente producción de anafilotoxinas, estas se unen a sus respectivos receptores localizados en los mastocitos dando lugar a la liberación de sus mediadores. Esta vía explica por qué la administración de medicamentos micelares o liposomales puede derivar en una anafilaxia no alérgica.16 Entre los fármacos de este grupo se encuentran algunas presentaciones de doxorrubicina, anfotericina B y daunorrubicina.17
Activación directa de los mastocitos mediante la activación del receptor MRGPRX2 (Mas-related G protein-coupled receptor X2). Otro tipo de anafilaxia no alérgica puede ser inducido por la activación directa del receptor MRGPRX2. Por esta vía puede no haber IgE específica detectable y los niveles de triptasa sérica pueden encontrarse en rangos de normalidad.18
Componentes de las vacunas que pueden provocar anafilaxia
Como ya se ha comentado, al igual que un fármaco, las inmunizaciones pueden presentar efectos adversos mediados por mecanismos de hipersensibilidad. No obstante, a diferencia de lo que sucede con los medicamentos, rara vez el principio activo (los antígenos de las vacunas, como los microrganismos enteros, fragmentos de estos o toxoides) es el responsable. Es más frecuente que estas reacciones se deban a excipientes, por ejemplo estabilizadores, adyuvantes, conservadores, antibióticos, sustancias residuales del medio de cultivo, látex.19,20
Estabilizadores
Gelatina (mediada por IgE)
La gelatina es un producto derivado del colágeno parcialmente hidrolizado de mamíferos (porcinos o bovinos) o peces. Hay que tener en cuenta que la gelatina de origen bovino o porcino tienen una reactividad cruzada amplia entre ellas, mas no completa.21 Es posible encontrar este excipiente en las vacunas contra el sarampión, la rubéola la parotiditis (SRP), la varicela, la influenza y la encefalitis transmitida por garrapatas.10 Igualmente, puede hallarse en las vacunas contra la fiebre amarilla y la rabia.22 Al contemplar esta sustancia como posibilidad etiológica de una anafilaxia a vacunas, esta no puede ser descartada si se tolera la ingesta de gelatina. Lo cual se debe a que dicha vía permite su digestión en pequeños fragmentos peptídicos con menor potencial alergénico.23
Hay que recordar que la gelatina está hecha a base de tendones, cartílago y piel de algunos mamíferos, por lo que representa una fuente potencial de proteínas con grados variables de glicosilación. También puede obtenerse del pescado, aunque su composición de aminoácidos es tan diferente que no hay reactividad cruzada con su contraparte en mamíferos.24 Este componente se puede hallar en distintos alimentos y en productos de uso médico, como agentes hemostáticos, líquidos intravenosos coloides, cápsulas, injertos y cánulas.25
Para su abordaje se puede recurrir a una IgE específica para gelatina o a pruebas epicutáneas, preparando un extracto que se obtiene al disolver 5g de gelatina azucarada de cualquier sabor en 5 mL de solución salina.26
En algunos países se ha quitado a la gelatina de las vacunas, o se ha optado por una variante completamente hidrolizada, lo que se ha asociado a una marcada disminución de las reacciones alérgicas a estas inmunizaciones.21
Alfa-gal (galactosa-alfa-1, 3-galactosa, mediada por IgE)
Este oligosacárido, que se encuentra en los tejidos de todos los mamíferos a excepción de los primates, debe tomarse en cuenta en anafilaxia a fármacos cuya manufactura se basa en líneas celulares de mamíferos o anticuerpos, tal es el caso del cetuximab.27 Por lo tanto, los paciente sensibilizados a los residuos de alfa-gal provenientes de carne de mamíferos pueden tener una cosensibilización o una coalergia a la gelatina.28 Un reporte de caso es una anafilaxia a la vacuna contra la varicela zóster, en un paciente con alergia conocida a carnes rojas.29
Dextrano (mediado por CARPA)
Las reacciones de hipersensibilidad a este estabilizador no son frecuentes, y son marcas específicas de las vacunas contra SRP y BCG las que se han visto involucradas, aunque ya no se encuentran disponibles en el mercado.30 El dextrano puede hallarse ocasionalmente en las vacunas contra el rotavirus. Se ha planteado que el mecanismo fisiopatológico participante es la pseudoalergia relacionada con la activación del complemento.31
Adyuvantes y conservadores
AS03
AS03 es el nombre comercial de un adyuvante basado en escualeno empleado en productos de GlaxoSmithKline). En Canadá se reportó un aumento en la tasa de anafilaxia y otras reacciones de hipersensibilidad inmediatas asociado con este adyuvante presente en la vacuna contra la influenza H1N1, pero hasta el momento no hay evidencia concluyente de que tales eventos se deben a este excipiente.32,33
Timerosal
Este conservador es utilizado cada vez con menos frecuencia, debido a su contenido de mercurio y a la supuesta intoxicación con este metal pesado.34 Sin embargo, se tiene que aclarar que el agente tóxico es el metilmercurio, no el etilmercurio (timerosal). Además, los estudios realizados al respecto no demuestran un vínculo entre la aplicación de las vacunas que contienen timerosal y los trastornos del espectro autista y del neurodesarrollo.35
Zheng y Dreskin estudiaron un cuadro de anafilaxia en una paciente adulta tras recibir una vacuna contra la influenza que contenía timerosal. Proponen que actuó como hapteno, pero no pudieron demostrar la presencia de IgE específica.36
Sustancias residuales del medio de cultivo
Proteína de leche de vaca (mediada por IgE)
Kattan et al. documentaron ocho casos de pacientes pediátricos que tuvieron anafilaxia a los refuerzos de las vacunas DTaP, DTP o Tdap. Todos ellos tuvieron en común una alergia grave a la proteína de la leche de vaca, caracterizada por niveles elevados de IgE específica para leche y con antecedentes de reacciones a productos contaminados con trazas de leche. Los empaques de las marcas Adacel, Boostrix, Daptacel, Infanrix, Kinrix, Pediarix y Pentacel especifican que la toxina tetánica es producida mediante el crecimiento de C tetani en un medio Latham modificado, derivado de la caseína bovina; o en un medio Mueller-Miller que contiene ácidos casamino derivados de la leche de vaca. Si bien se debe continuar con el esquema de inmunización habitual, este estudio sugiere precaución al aplicar estas dosis de refuerzo en niños altamente sensibles a la proteína de leche de vaca.20,37
Ovoalbúmina (mediada por IgE)
La alergia al huevo afecta entre 0.5 % y 2 % de la población pediátrica. La mayoría de los pacientes la superan en una edad escolar, aunque puede persistir ocasionalmente o debutar incluso en la etapa adulta.38 En países en vías de desarrollo no se cuenta con información precisa respecto de su prevalencia; sin embargo, se considera que es una de las principales causas de alergia alimentaria.39 Si bien algunas vacunas (SRP, influenza y fiebre amarilla) pueden contener ovoalbúmina por el medio en el que se desarrollan, y anteriormente se recomendaba evitar su aplicación en pacientes alérgicos al huevo, estas directrices se han modificado recientemente.21
La vacuna SRP se produce en cultivos de fibroblastos de embriones de pollo, pero su contenido de ovoalbúmina se ha estimado en nanogramos.21,40 Por lo tanto, es una cantidad muy reducida como para esperar que pudiera desencadenar una reacción alérgica, y no está contraindicada su aplicación en pacientes con alergia al huevo.41,42
Las vacunas contra la influenza (IIV y LAIV) derivan del cultivo del virus en embriones de pollo. Esto justificó su evitación en pacientes con esta alergia alimentaria, por la presencia de proteínas de huevo y reportes de anafilaxia tras su aplicación.43 No obstante, esta última recomendación ha cambiado, ya que en la actualidad no solo existen vacunas recombinantes, sin uso de huevo, desarrolladas en líneas celulares de mamíferos; sino también en la fabricación habitual que ha limitado su contenido de ovoalbúmina a 1 µg por dosis, con un bajo riesgo de reacción alérgica. No es necesario dividir la dosis, ni realizar un abordaje diagnóstico previamente, ni asegurar la tolerancia a la ingesta de este alimento, siempre y cuando se cumpla con estas características.44 Para asegurarse del tipo de inmunización y de su contenido de ovoalbúmina se puede consultar la página web https://www.vaccinesafety.edu, cuyos detalles se explican más adelante en este texto.
Las únicas vacunas para las cuales los pacientes con alergia a huevo ameritan una valoración previa por parte de un alergólogo son las de la fiebre amarilla y la fiebre Q, ya que son las inmunizaciones con la mayor concentración residual de proteína de huevo.44
Levaduras
Las vacunas de hepatitis B y la cuadrivalente del virus de papiloma humano pueden contener proteínas residuales de la levadura Saccharomyces cerevisiae, hasta 25 mg por dosis y 7 µg por dosis respectivamente.21,45,46 También se ha reportado en las vacunas neumocócica (PCV13) y en algunas contra meningococo y tifo oral.47 La alergia a esta levadura y las reacciones adversas atribuidas a su presencia en las vacunas son muy raras. En caso de que el paciente refiera alergia en cualquiera de estas dos situaciones es conveniente realizar un abordaje diagnóstico.10
Antibióticos
Es probable que las vacunas SRP, contra la poliomelitis y la influenza contengan pequeñas cantidades de neomicina, gentamicina, polimixina B y estreptomicina, las cuales se usan para evitar la contaminación del medio de cultivo con bacterias u hongos.30 Si bien las dosis terapéuticas tienen una nimia probabilidad de provocar una reacción sistémica, la asociación con las inmunizaciones no ha sido bien documentada al tratarse de trazas. De abordar a un paciente con una alergia inmediata confirmada a estos antibióticos se recomienda evitar la aplicación de vacunas que los contengan.48
Látex (mediado por IgE)
La exposición a látex en las vacunas se relaciona con el empaque, ya sea en los viales o en los émbolos de las jeringas.10 A diferencia de lo que sucede con los productos de látex flexibles, la forma del látex en estos componentes no permite su fácil extracción.49 Es por esta razón que los cuadros de anafilaxia a vacunas secundarios al látex son muy infrecuentes. Al momento de aplicar una inmunización en un paciente alérgico al látex, solo se requiere tener la precaución de emplear guantes libres de este producto.21
Liposoma pegilado (mediado por IgE o CARPA)
En las nanopartículas pegiladas, el polietilenglicol (PEG) es un compuesto de poliéter derivado del óxido de etileno conjugado en forma de micela (monocapa lipídica) o liposoma (bicapa lipídica) que se utiliza como plataforma de administración de distintos productos. Este componente se encuentra habitualmente como excipiente en artículos, por ejemplo laxantes, corticoesteroides, antibióticos, cosméticos, emolientes y jabones.50 En el caso de las inmunizaciones, el PEG está presente en las vacunas de ARNm.51 Los alérgenos potenciales de la vacuna de Pfizer-BioNtech son el 2-[polietilenglicol-2000]-N y la N-ditetradecilacetamida, mientras que el de la vacuna de Moderna es el PEG2000 dimirostoil glicerol.52,53
La alergenicidad del PEG se correlaciona con su peso molecular.19 Si bien se han descrito reacciones de hipersensibilidad mediadas por IgE y CARPA, hasta el momento es limitada la evidencia sobre el componente responsable de los efectos adversos reportados para las vacunas contra COVID-19. Las agencias europea y estadounidense que regulan medicamentos recomiendan que no se les aplique la segunda dosis a los pacientes con una reacción de hipersensibilidad documentada a cualquier vacuna contra la COVID-19, o alguno de sus componentes.54
Para el abordaje diagnóstico no hay extractos aprobados de PEG para su uso en humanos. El único PEG puro de uso clínico y disponible comercialmente para pruebas cutáneas es la solución de Macrogol a 10 % (PEG 3350). Otros protocolos recomiendan usar el PEG contenido en las presentaciones de esteroides inyectables, ya que no habría interferencia con la interpretación inmediata de estos estudios; sin embargo, es la concentración de PEG que contienen es baja.55,56
Polisorbatos (mediados por IgE o CARPA)
Los polisorbatos son estructuralmente similares a PEG al contar con múltiples cadenas repetidas derivadas del óxido de etileno. Al tener cualidades similares se utilizan también como excipientes en múltiples fármacos, y en el caso de las inmunizaciones son potenciales alérgenos de las vacuna de AstraZeneca ChAdOx1, Ad26.COV2.S y Novavax NVX-CoV2373.54,57
Pacientes alérgicos al polisorbato se han sensibilizado vía polietilenglicol, por medio de un mecanismo mediado por IgE.50 Se ha reportado reactividad cruzada entre PEG 3350 y PS80 en pacientes que han presentado reacción para ambos, teniendo como fundamento la similitud de las estructuras químicas de ambos componentes.58 Es importante comentar el trabajo realizado por Bruusgard-Mouritsen et al., en el cual tres de los 10 pacientes alérgicos a PEG presentaron pruebas cutáneas positivas para polisorbato 80 a 20 %. Sin embargo, no es claro si estos resultados se traducen a una reacción de hipersensibilidad cruzada clínicamente relevante.59
Para conocer los componentes de las inmunizaciones y las concentraciones a las que se encuentran, y de esta manera determinar las pruebas diagnósticas, se recomienda el sitio web del Institute for Vaccine Safety, dependiente del departamento de Salud Internacional de la Escuela de Salud Pública de la Universidad de Johns Hopkins. En la sección Vaccine information hay un apartado acerca de los componentes de las vacunas donde se pueden encontrar tablas de componentes, excipientes y alérgenos (https://www.hopkinsvaccine.org/).60
Diagnósticos diferenciales
Cuando no se cumple con la definición de anafilaxia, se tienen que considerar diagnósticos alternativos, más frecuentes que la anafilaxia asociada con vacunas (Cuadro 4).
Cuadro 4 Diagnóstico diferencial de la anafilaxia a vacunas
| Anafilaxia | Síncope vasovagal | Síndrome oculorrespiratorio | Episodio hipotónico hiporreactivo | |
| Tiempo de inicio | Dentro de las primeras cuatro horas, aunque típicamente en los primeros 15 min | Durante o poco después de la aplicación | Dentro de las primeras 24 h | Dentro de las primeras seis horas |
| Síntomas respiratorios | Sibilancias, estridor | Normal o hiperventilación | Tos, odinofagia, disfagia, sibilancias, dificultad respiratoria, opresión torácica | - |
| Síntomas cardiovasculares | Taquicardia, hipotensión | Bradicardia autolimitada, hipotensión | - | - |
| Síntomas cutáneos | Eritema generalizado, urticaria, angioedema prurito | Palidez generalizada, diaforesis, piel fría | Edema facial, hiperemia conjuntival bilateral | Palidez generalizada |
| Síntomas gastrointestinales | Dolor abdominal, vómito, diarrea | Náusea, vómito | - | - |
| Síntomas neurológicos | Pérdida o alteración del estado de alerta, sin respuesta a la posición en prono | Pérdida del estado de alerta autolimitada, buena respuesta a la posición en prono | - | Pérdida súbita del estado de alerta, falta de respuesta a estímulos, hipotonía |
| Edad | Cualquier edad | Predominio en adolescentes | Cualquier edad | Predominio en lactantes |
| Vacuna asociada | - | - | Influenza | - |
| ¿Mediado por IGE? | Sí | No | No | No |
Síndrome oculorrespiratorio
El síndrome oculorrespiratorio se presenta dentro de las primeras 24 horas posteriores a la aplicación de una vacuna. Se caracteriza por algunos de los siguientes síntomas: hiperemia conjuntival bilateral, síntomas respiratorios (tos, odinofagia, disfagia, sibilancias, dificultad respiratoria y opresión torácica) o edema facial. No se trata de una reacción de hipersensibilidad inmediata; y se asocia a vacunas de influenza con alta concentración de partículas de viriones agregados.61
Síncope vasovagal
Se distingue de la anafilaxia por una hipotensión transitoria asociada con bradicardia, en lugar de taquicardia. Puede ocurrir a cualquier edad, aunque se ha convertido en una reacción adversa frecuente entre los adolescentes, quienes se encuentran en una situación de mayor riesgo.62
Episodio hipotónico hiporreactivo
En un lactante, dentro de las primeras seis horas tras recibir una vacuna, el episodio hipotónico hiporreactivo puede ser un diagnóstico diferencial. Consiste en la pérdida súbita del estado de alerta, hipotonía, palidez generalizada de tegumentos y la falta de respuesta a estímulos. No obstante, lo que va a diferenciarlo es la ausencia de compromiso cardiovascular, específicamente de hipotensión.63
Abordaje diagnóstico de la anafilaxia a vacunas
Dada la importancia de las vacunas para la salud pública, la sospecha de una anafilaxia secundaria a su aplicación obliga a una oportuna referencia y a un correcto abordaje diagnóstico, no tan solo en beneficio del paciente sino también con el propósito de mejorar el perfil de seguridad de las vacunas. Los casos deben ser evaluados con criterios estrictos que permitan asignar una probabilidad; además, deben reportarse a la autoridad local competente.
El primer paso corresponde a la identificación del cuadro de anafilaxia. Posteriormente, se debe llevar a cabo una historia clínica exhaustiva y analizar la causalidad. El interrogatorio se debe enfocar en preguntas de alergias conocidas por ejemplo al látex, a los alimentos o a las inmunizaciones y sus componentes (20). El Global Advisory Committee for Vaccine Safety de la Organización Mundial de la Salud elaboró una lista de cotejo para establecer una relación de causalidad entre el evento estudiado y la aplicación de una vacuna.20 Esto se justifica porque del universo de eventos adversos supuestamente atribuibles a la vacunación, es muy poco probable que el cuadro sea parte del conjunto de una verdadera reacción alérgica y en realidad se trate de una coincidencia.64 De ser consistente con un reacción grave mediada por un mecanismo de hipersensibilidad inmediata se debe proceder con la confirmación de la reactividad a la vacuna, para lo cual se cuenta con estudios in vivo y ex vivo14 (Figura 2).

Figura 2 Abordaje sugerido para evaluar y reportar los casos de reacciones de hipersensibilidad inmediatas a vacunas. Referencia 14.
La pregunta en este punto es: ¿a todos los pacientes con una posible reacción de hipersensibilidad a vacunas se les debe someter a pruebas cutáneas o protocolos de dosis dividida? (Figura 3). Cheung et al. y Zafack et al. coinciden en que estas maniobras deben reservarse para aquellos con cuadro compatible con un mecanismo mediado por IgE que se presenta en la primera hora tras la aplicación de la vacuna, o con un evento congruente con anafilaxia, sin importar el intervalo de tiempo. Este procedimiento es suficientemente sensible para la correcta identificación de los pacientes con mayor riesgo de anafilaxia al repetir la inmunización. Si las pruebas cutáneas (epicutáneas e intradérmicas) son negativas, el reto a la vacuna se puede realizar según los protocolos de dosis única o uno de dosis dividida, es decir, 10 % del total en primera instancia y al cabo de 30 a 60 minutos el 90 % restante. Si las pruebas cutáneas son positivas, la vacuna responsable se contraindica y se puede continuar con pruebas cutáneas a excipientes, marcas alternativas, un protocolo de desensibilización o solicitar títulos de anticuerpos IgG protectores para ponderar la necesidad de la vacuna.64,65

Figura 3 Algoritmo sugerido para el abordaje de las reacciones de hipersensibilidad a vacunas. Referencia 68.
En un estudio en el que participaron 20 voluntarios sanos sin antecedentes de alergia alimentaria o a fármacos, o de reacciones adversas a vacunas, Wood et al. definieron las concentraciones no irritativas para las pruebas cutáneas para vacunas. Por esta razón, para las pruebas epicutáneas se utiliza la vacuna sin diluir, mientras que para las pruebas intradérmicas se emplea la dilución 1:100. Hay que tener en cuenta que se trata de una muestra reducida, que los datos de las dosis irritativas se basan en la experiencia clínica y que ni su sensibilidad ni su especificidad han sido determinadas.66,67
Si las pruebas cutáneas son positivas, y se considera indispensable la inmunización en el paciente afectado y no se cuenta con una presentación alternativa, entonces se debe aplicar la vacuna en dosis graduales. Este protocolo debe conducirse en un ambiente controlado, por personal capacitado, espaciando cada porción a intervalos de 15 a 30 minutos de tolerancia y vigilancia por una hora al concluirlo. Cabe destacar que aun finalizando el proceso exitosamente, el paciente debe ser considerado como alérgico a la vacuna en cuestión. A continuación, se desglosa el protocolo de desensibilización cuando el volumen total es de 0.55 mL:
Anafilaxia a vacunas contra COVID-19
En el periodo que comprende del 14 de diciembre al 23 de diciembre de 2020, se aplicaron 1 893 360 primeras dosis de la vacuna contra la COVID-19 de la marca Pfizer-BioNTech. Los Centros para el Control y la Prevención de las Enfermedades (CDC, por sus siglas en inglés) identificaron 21 casos reportados mediante el Vaccine Adverse Event Reporting System (VAERS) que cumplían con los criterios de Brighton para anafilaxia, dando así una tasa de 11.1 casos por 1 000 000 de vacunas administradas.
La mediana de tiempo entre la recepción de la inmunización y el inicio de síntomas fue de 13 minutos, en 15 pacientes las manifestaciones clínicas se presentaron al cabo de 15 minutos, mientras que en 18 de ellos el cuadro debutó en los primeros 30 minutos. Los síntomas más frecuentes fueron urticaria, angioedema, erupción cutánea y sensación de cuerpo extraño en laringe. De los pacientes con anafilaxia, 21 % comentaron tener antecedentes de alergias o reacciones alérgicas, y siete pacientes ya habían tenido un episodio previo de anafilaxia (uno después de recibir la vacuna contra la rabia, y otro posterior a la vacuna contra la influenza A [H1N1])68,69
En el reporte del 14 de diciembre de 2020 al 18 de enero de 2021, se señala que de un total de 9 943 247 vacunas aplicadas, los CDC identificaron 66 casos de anafilaxia: 47 tras la vacuna de Pfizer-BioNTech (4.7 casos por 1 000 000 de vacunas administradas) y 19 después de la vacuna Moderna (2.5 casos por 1 000 000 de vacunas administradas).70
Mientras tanto, en el Reino Unido en el primer día de la campaña de vacunación contra COVID-19 se reportaron dos casos de anafilaxia en los primeros minutos luego de la aplicación de la vacuna de Pfizer-BioNTech, así como un tercer caso de una reacción alérgica que no requirió epinefrina.71
La incidencia de anafilaxia secundaria a estas vacunas se reporta como hasta 10 veces mayor que la alcanzada con otras inmunizaciones (11.1 casos por 1 000 000 de vacunas aplicadas comparados con 0.65 casos por 1 000 000 de vacunas aplicadas). Rasmussen et al. realizaron un estudio que incluyó a 61 pacientes con sospecha de una reacción alérgica a las vacunas contra COVID-19. De este total, solamente nueve cumplieron con los criterios de Brighton para definir un caso de anafilaxia a vacunas, pero después de haber realizado un abordaje diagnóstico no se comprobó ningún caso de anafilaxia inmediata a causa de estas vacunas. De 55 pacientes que presentaron una reacción a la primera dosis, 52 de ellos fueron inmunizados en una segunda ocasión sin presentar efectos adversos.72
Como se comentó, el PEG es el alérgeno potencial de los casos de anafilaxia reportados tras la aplicación de las vacunas contra COVID-19, específicamente de las de ARNm (Pfizer-BioNTech y Moderna). Si bien las reacciones de hipersensibilidad a este componente pueden ser graves e incluso fatales, la alergia a PEG es rara.
Hasta el momento de elaboración de este trabajo, solo se ha reportado un caso de anafilaxia a la vacuna de Pfizer-BioNTech en el que el PEG fue el alérgeno responsable. Se trató de una mujer de 52 años con antecedente de múltiples reacciones alérgicas a distintos productos que contienen PEG (azitromicina, champús, acondicionadores, geles de ducha, pastas dentales y enjuagues bucales). Sus pruebas epicutáneas fueron positivas para PEG 4000 a 1 %.73 El diagnóstico de una alergia a PEG es complejo y amerita una revisión extensa por separado. Sin embargo, es importante tener esta sospecha diagnóstica en personas que refieran múltiples reacciones alérgicas a productos estructuralmente no relacionados. Asimismo, hay que recordar que mientras mayor sea el peso molecular del PEG, mayor es su potencial alergénico, y que este componente se encuentra de manera habitual como excipiente en artículos como laxantes, corticosteroides, antibióticos, cosméticos, emolientes y jabones, entre otros .50
Conclusión
Como en cualquier otro fármaco, la anafilaxia es un evento que puede presentarse tras la aplicación de una vacuna. No obstante, es un escenario poco frecuente y sus beneficios superan el riesgo reportado. También es importante recordar que la anafilaxia puede ser mediada por mecanismos de hipersensibilidad no alérgicos.
El entendimiento de los criterios diagnósticos y los escenarios clínicos de una anafilaxia a vacunas es crucial para ofrecer una atención oportuna y referir al paciente a un alergólogo que pueda profundizar en los desencadenantes posibles y otorgar un plan de inmunización seguro.
Respecto a las vacunas contra SARS-CoV-2, queda relativamente contraindicada la aplicación de una vacuna de ARNm si se sospecha una reacción alérgica a PEG. Si el paciente ha tolerado la vacuna contra la influenza u otro fármaco inyectado que contenga polisorbato 80, entonces se puede optar por las vacunas contra COVID-19 de AstraZeneca o Janssen/Johnson & Johnson. En la Figura 4 se sugiere un algoritmo para vacunar a los pacientes según su riesgo para presentar reacción adversa.
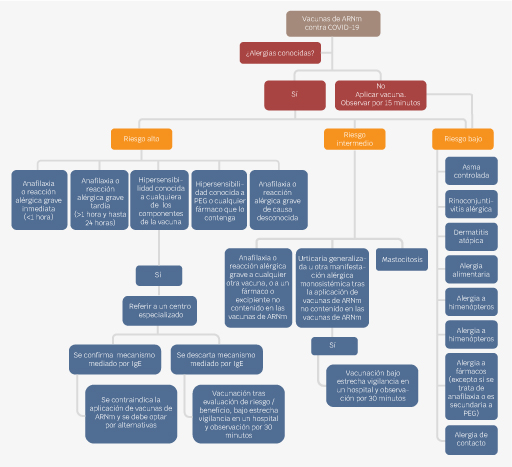
Figura 4 Este diagrama de flujo fue traducido y adaptado a partir del elaborado por el Paul-Ehrlich-Institut y el Robert Kock Institut en conjunto con las sociedades científicas AEDA, DGAKI, NORA y DDG. Se puede observar que el abordaje dependerá del riesgo de presentar una reacción adversa. Cabe destacar que la referencia a un servicio de alergia y un periodo de vigilancia más extenso se justifican en los grupos de riesgo moderado y alto. Referencia 77.











 nueva página del texto (beta)
nueva página del texto (beta)



