Introducción
El cáncer de ovario es una enfermedad con alta letalidad, ya que al carecer de un estudio de cribado para un diagnóstico oportuno, generalmente se detecta en etapas III/IV, teniendo una recurrencia superior al 70% y una supervivencia global a 10 años del 16%. Cabe mencionar que la edad promedio de diagnóstico es a los 50 años1.
El cáncer epitelial de ovario es una enfermedad heterogénea con características clínicas y moleculares distintas para cada subtipo. Un 15% de todos los cánceres de ovario cuentan con una mutación germinal en los genes BRCA, prevalencia que puede llegar a ser hasta de un 18% para los cánceres de ovario serosos de alto grado (SAG)2 y el 50% de estos tumores tendrá deficiencias en los procesos de reparación-recombinación homóloga (RRH) del ADN3. Este tipo de tumores se caracteriza por una alta sensibilidad y tasa de respuestas con el uso de quimioterapia basada en sales platinadas y una edad temprana al momento del diagnóstico4. Hasta un 40% de las mujeres con una mutación germinal en BRCA pueden no tener historia familiar de cáncer de ovario. El síndrome de Lynch es la segunda causa más común de cáncer de ovario hereditario, siendo el 2% de todos los casos de cáncer de ovario. La vía de RRH del ADN involucra otros genes, además de los genes BRCA, tales como RAD51C, RAD51D y BRIP1, que en conjunto pueden llegar a representar el 2% de los cánceres de ovario hereditarios5.
Reporte de casos
Se trata de dos pacientes de sexo femenino de 18 años de edad, A y B, originarias de la Ciudad de México, que se refirieron para su atención médica al Centro Médico Nacional 20 de Noviembre, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, en la Ciudad de México.
Paciente A
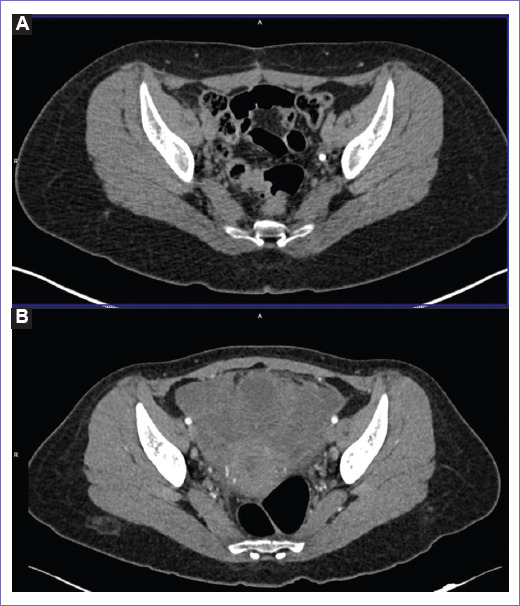
Mujer de 18 años, con antecedentes familiares de un cáncer de colon en un hombre de 60 años, una leucemia mieloide aguda en un hombre de 25 años y un sarcoma de tejidos blandos en un hombre de 70 años. Inició padecimiento en marzo de 2020 con dolor lumbar, fatiga y distensión abdominal, abordada como un síndrome de intestino irritable. En julio de 2020 se realizó tomografía de abdomen, en donde se muestra una tumoración dependiente de ovario izquierdo con dimensiones de 201 x 101 x 134 mm, lesiones metastásicas en bazo de 7 mm, en músculo recto abdominal de 27 x 15 mm, así como en pulmón de 7 a 9 mm y CA-125 de 1314 U/mL. En agosto de 2020 se llevó a laparotomía diagnóstica con toma de biopsia transoperatoria en donde se reportó carcinoma seroso invasor micropapilar de alto grado, permeación linfovascular presente y líquido de ascitis positivo para infiltración por carcinoma seroso (Fig. 1), con inmunohistoquímica MLH1, MSH2, MSH6, PMS2 con expresión conservada, receptores de estrógeno y progesterona positivo. Se realizó una tomografía por emisión de protones/tomografía computarizada (PET/CT) el 25 agosto de 2020 con evidencia de actividad tumoral mediastinal, pleural, peritoneal y esplénica (Fig. 2 A y B). Se clasificó a la paciente en una etapa clínica IV de acuerdo con la Federación Internacional de Ginecología y Obstetricia (FIGO). Se determinó BRCA 1/2 con reporte wild type. Se inició quimioterapia neoadyuvante por características clínicas de alto riesgo el 26 de agosto de 2020, con un total de cuatro ciclos a base de paclitaxel 175 mg/m2 y carboplatino AUC 5 Q3W, hacia segundo ciclo se decide iniciar bevacizumab a 15 mg/kg. Se observó respuesta serológica en el cuarto ciclo de tratamiento con CA-125 a 117 U/mL. El 27 noviembre de 2020 se realizó PET/CT con respuesta parcial (Fig. 2 C y D).

Figura 1 Revisión de laminillas de biopsia de ovario. Adenocarcinoma papilar seroso de alto grado de ovario, con cuerpos de psammoma (tinción hematoxilina- eosina).

Figura 2 A y B: tomografía por emisión de positrones/tomografía computarizada (PET/CT) del 25 de agosto de 2020, actividad tumoral mediastinal, pleural, peritoneal, omental y esplénica. C y D: PET/CT 27 de noviembre de 2020, respuesta parcial con persistencia de implante subcutáneo debajo de apéndice xifoides SUVmáx de 5, en hígado segmento V se reporta un tumor con SUVmáx 2.8 (previo 12), tumor en omento cuadrante 3 SUVmáx 7.2 (previo de 11.9), implantes periesplénicos nivel 3 SUVmáx 5.6 (previo de 11.2), tumoración pélvica de 87 x 89 mm (previo de 127 x 116 mm).
Se llevó a cirugía de intervalo el 3 de diciembre de 2020 en donde se reportó presencia de pelvis congelada sin posibilidad de citorreducción. Se reinició el tratamiento con quimioterapia el 5 de enero de 2021 y completó siete ciclos el 16 de febrero de 2021. Se consideró candidata a tratamiento con niraparib, pero no lo recibió porque presentó progresión de la enfermedad por oclusión intestinal y se realizó ileostomía. Actualmente en tratamiento paliativo con quimioterapia monodroga, ha presentado progresión, derrame pericárdico (Fig. 3), trombosis venosa profunda, y sigue viva con enfermedad.
Paciente B
Mujer de 18 años sin antecedentes familiares oncológicos. Inició padecimiento en enero de 2020 con aumento del perímetro abdominal. En marzo de 2020 acudió a valoración con gastroenterología por ascitis, se realizaron marcadores tumorales: alfafetoproteína 0.5 ng/ml, gonadotropina coriónica humana 0.1 mU/ml y lactato deshidrogenasa láctica 133 U/l. El 4 de marzo de 2020 se realizó paracentesis diagnóstica, obteniendo 4,500 ml de líquido citrino positivo a células de adenocarcinoma.
Un ultrasonido transvaginal de marzo de 2020 reportó la presencia de tumoración dependiente del ovario derecho O-RADS (Ovarian-Adnexal Reporting Data System Magnetic Resonance Imaging) 5. Y una tomografía de abdomen con ganglios retroperitoneales, paraaórticos y carcinomatosis peritoneal. Se realizó determinación de BRCA 1/2 con reporte de wild type.
El 20 de marzo de 2020 se sometió a laparotomía diagnóstica con toma de biopsia transoperatoria en donde se reportó cistoadenocarcinoma papilar seroso de alto grado (SAG). Se realizó protocolo de ovario con cirugía óptima (Fig. 4). Se clasificó como una etapa IIIC de acuerdo con la FIGO. El 3 de abril de 2020 se inició quimioterapia adyuvante con carboplatino AUC 5, paclitaxel 175 mg/m2 y bevacizumab 15 mg/kg.

Figura 4 Biopsia de ovario. Adenocarcinoma papilar seroso de alto grado. Se observan numerosas proyecciones papilares (tinción hematoxilina-eosina).
PET/CT con respuesta completa el 31 de agosto de 2020 (Figs. 5 y 6). En septiembre de 2020 se detectó una lesión en mama izquierda con área de eccema de 6 cm con superficie rugosa y bordes bien definidos con sospecha de segundo primario de mama. Se realizó biopsia de mama con reporte de eccema e inició tratamiento dermatológico, con remisión completa de la lesión. Actualmente viva sin evidencia de enfermedad radiológica, con CA-125 negativo, y con un intervalo libre de progresión de un año y seis meses.
Discusión
Se presentan los casos de dos mujeres de 18 años, ambas con diagnóstico de un adenocarcinoma de ovario SAG, BRCA wild type, con metástasis viscerales y con respuesta a la quimioterapia basada en platino, que posteriormente recibieron tratamiento de mantenimiento. Los cánceres de ovario en mujeres menores de 25 años son raros, en una cohorte de 12,136 mujeres con cáncer de ovario de los EE.UU. solamente 135 pacientes, esto es, el 1.1%, corresponden a este grupo de edad. En este grupo de mujeres, los cánceres de ovario usualmente se presentan en etapas tempranas y son de bajo grado, con una tasa de supervivencia cáncer específica a cinco años del 76%. Sin embargo, para pacientes con una diferenciación histológica grado 3 el porcentaje de supervivencia cáncer específico a cinco años puede disminuir a un 33%6. Más de un quinto de los casos de cánceres de ovario serosos de alto grado se pueden relacionar con condiciones hereditarias y en aproximadamente en el 65 al 85% de estos casos se deberá a una mutación germinal o somática en los genes BRCA1 o BRCA2. El resto puede estar relacionado con un síndrome Lynch con mutaciones en MLH1, MSH2 o MSH6, o con alguna mutación con pérdida de función de los genes involucrados en la reparación del ADN. El ADN sufre daño de forma constante por lo que las células cuentan con una red molecular extensa con la cual son capaces de reparar y mantener la integridad genómica; dos de las vías principales de reparación celular son la recombinación homóloga y la unión de extremos no homólogos. La recombinación homóloga actúa principalmente en la fase S y G2 del ciclo celular e involucra a las proteínas de los siguientes genes: BRCA, CtIP, MRE11, RAD51, ATM, H2AX, PALB2, RPA y RAD52, así como a proteínas de la vía de la anemia de Fanconi. La deficiencia de cualquiera de estas proteínas conlleva inestabilidad genómica y activación de diferentes procesos de apoptosis. Cada vez está más claro que una proporción de pacientes con cáncer de ovario SAG se presenta sin mutaciones germinales en BRCA, las cuales pueden tener respuestas similares al tratamiento con platinos e inhibidores de la poli(ADP)-ribosa polimerasa (PARP), condición que se ha denominado BRCAness en inglés y refleja una alteración en los procesos de reparación del ADN usualmente relacionados con alguna mutación con pérdida de función en los genes responsables de llevar a cabo la RRH7.
Agregado a los errores en la reparación del ADN por las alteraciones genómicas previamente mencionadas, el uso de antiangiogénicos puede favorecer en las células de cáncer de ovario un ambiente tumoral hipóxico creando una regulación a la baja de las proteínas involucradas en los procesos de recombinación homóloga, con lo cual se suma a forma de sinergismo un mayor efecto antitumoral cuando se combinan con los inhibidores de PARP8. Olaparib, niraparib y la combinación de olaparib/bevacizumab cuentan con aprobación por la FDA (Food and Drug Administration) para su uso en pacientes con cáncer de ovario SAG, etapa clínica III y IV, con respuesta a quimioterapia basada en platinos y que tengan presentes mutaciones germinales o somáticas en BRCA y/o inestabilidad genómica analizada por medio de Myriad Mychoice®9-11.
Recientemente el uso de rucaparib demostró beneficio en una población de mujeres con cáncer epitelial de ovario SAG no seleccionada con base en biomarcador, tanto en BRCA wild type como para pacientes que no cuentan con pérdida de la estabilidad genómica medida por FoundationOneCDX®12. Así mismo, el uso de bevacizumab ha demostrado beneficio en supervivencia global en las pacientes con cáncer de ovario SAG, con características de alto riesgo clínico, es decir, mujeres con etapas clínicas IV, etapas clínicas III no operadas, etapas clínicas III con enfermedad residual > 1 cm, y sobre todo en pacientes con presencia de ascitis13-15.
Se presentan los casos de dos pacientes menores de 25 años, con alto riesgo clínico, que no contaban con mutaciones germinales o somáticas en BRCA, sin disponibilidad del análisis de estabilidad genómica. Se decidió iniciar tratamiento con quimioterapia basada en platino y antiangiogénico. En la paciente A posterior a una cirugía no óptima, inicialmente se consideró candidata a tratamiento de mantenimiento con niraparib, grupo que en PRIMA mostró una tendencia al beneficio en supervivencia libre de progresión sin significancia estadística. Pero no fue posible el inicio de tratamiento en esta paciente debido a progresión de la enfermedad por oclusión intestinal.
Por otro lado, el rucaparib demostró en ATHENA beneficio en pacientes con BRCA wild type en la población de intención de tratar, independientemente del estado de la inestabilidad genómica, por lo cual podría ser una opción de tratamiento.
En la paciente B, la presencia de ascitis funcionó como un factor predictivo para el inicio de bevacizumab, el cual ha demostrado impacto en supervivencia global. Y como se ha mencionado previamente, los inhibidores de PARP se han vuelto un estándar de tratamiento en pacientes seleccionadas de acuerdo con biomarcadores (BRCA, estabilidad genómica). Por otro lado, en las pacientes sin biomarcador positivo como es el caso de la paciente B, queda aún la pregunta por responder de si se tendría un mayor beneficio al dar un tratamiento con la combinación de bevacizumab + inhibidor de PARP o terapia única con inhibidor de PARP o bevacizumab.
El tratamiento del cáncer de ovario está evolucionando constantemente, hoy en día se está evaluando la combinación de diferentes formas de tratamiento como inmunoterapia, anticuerpos conjugados, quimioterapia, antiangiogénicos e inhibidores de PARP16-18.











 nueva página del texto (beta)
nueva página del texto (beta)