Introducción
En la actualidad, se cuenta con tecnologías agrícolas sustentables que permiten reducir el impacto ambiental causado por el uso de fertilizantes químicos y además aumentan la disponibilidad de nutrimentos para las plantas, entre estas tecnologías destacan los bio-fertilizantes formulados con hongos micorrizógenos arbusculares (HMA). Los HMA son simbiontes obligados de las plantas con capacidad de conferirles resistencia a distintos tipos de estrés biótico y abiótico (Salmerón-Santiago et al., 2015).
Un número importante de plantas cultivadas y no cultivadas captan sus nutrimentos por medio de interacciones con los HMA (Gosling et al., 2006; Mahmood y Rizvi, 2010). Estos hongos incrementan el índice de clorofila, el contenido foliar de elementos químicos (Díaz et al., 2016), confieren tolerancia a la salinidad (Medina-García, 2016) e incluso, favorecen la tolerancia a la sequía mediante la alteración de los perfiles hormonales de las plantas (Ruiz-Lozano et al., 2016). Hay evidencias que indican que los HMA favorecen el crecimiento radical y mejoran la producción de biomasa; lo que resulta en plantas más vigorosas y tolerantes a los daños causados por plagas (Cruz et al., 1998; Mahmood y Rizvi, 2010; Gañán et al., 2011).
En ecosistemas agrícolas, se ha descrito ampliamente que la micorriza arbuscular favorece el crecimiento vegetal; la colonización micorrízica produce cambios físicos, bioquímicos y fisiológicos en las raíces que mejoran el estado general de las plantas y contribuyen a aliviar el estrés abiótico (metales pesados, salinidad, etc.) y bióticos (daños por fitopatógenos, cambios microbianos en la rizósfera, etc.). Varios estudios han demostrado que la inoculación con HMA mejora el crecimiento de las plantas bajo estrés salino, esto puede ser atribuido al incremento en la adquisición de nutrientes minerales como fósforo (P), zinc (Zn), cobre (Cu), hierro (Fe) y otros. También existen indicios que los HMA protegen el metabolismo de las hojas de la toxicidad por sodio (Cruz et al., 1998; Medina-García, 2016). Sin embargo, las prácticas agrícolas son los principales factores de perturbación que cambian la microbiota y reducen negativamente la riqueza de HMA, cuya importancia ecológica es clave para reducir la dependencia de los cultivos a la fertilización química (Chimal-Sánchez et al., 2015).
La identificación de HMA en agroecosistemas es escasa, por lo que es necesario realizar estudios sobre diversidad en cultivos con manejo agronómico intensivo (Schalamuk et al., 2003; Palenzuela et al., 2011; Pérez-Luna et al., 2012; Oehl et al., 2015). El conocimiento preciso de la diversidad de HMA en un suelo agrícola puede contribuir a generar estrategias adecuadas para su conservación y manejo (Chimal-Sánchez et al., 2016). La determinación de especies de HMA es mediante características morfológicas de las esporas (estructura subcelular, hifa de sostén, forma de germinación de la espora, color, tamaño) (Oehl et al., 2008; Schüβler y Walker, 2010; Redecker et al., 2013; Rivera et al., 2016). Este método es fundamental para la determinación a nivel de especie; sin embargo, las herramientas moleculares han sido un aporte importante en su identificación (Estrada et al., 2011; Oehl et al., 2011, 2015; Pereira et al., 2016).
En las regiones de México donde se cultiva el trigo son pocos los estudios sobre la identificación de especies de HMA y la mayoría están enfocados al uso de HMA como biofertilizantes (Borie et al., 1998; Portilla et al., 1998; Montaño et al., 2001; Covacevich et al., 2005). Además, el manejo intensivo de los suelos en este cereal podría ocasionar la pérdida de microrganismos benéficos. Por esto, en esta investigación se planteó como objetivo determinar la diversidad e identificar taxonómicamente las especies de HMA en terrenos con monocultivo de trigo manejado con dosis altas de fertilización inorgánica.
Materiales y métodos
Área de estudio
El estudio se llevó a cabo en diez parcelas colindantes (Potrero de Ramos, Potrero la Abundancia, San Carlos, El Charco, El Cuervo, Las Víboras, La Cruz, El Cazcorvo, El Calicanto y El Cisne) pertenecientes a la localidad de La Calera (Nacimientos) del municipio José Sixto Verduzco, localizado al norte del estado de Michoacán, México, entre los paralelos 20° 09’ y 20° 20’ de LN y 101° 26’ y 101° 40’ de LO y altitud entre 1,700 y 2,100 msnm.
El clima es templado con lluvias de verano, precipitación pluvial de 799.4 mm anuales, la temperatura oscila entre 2.5 y 36 °C. El tipo de suelo predominante es el Vertisol en 93 % (INEGI, 2021). Todos los suelos presentan textura arcillosa: arena (17.6 %), limo (30 %) y arcilla (52.4 %).
En esta localidad tradicionalmente se ha sembrado trigo en invierno y en el ciclo agrícola primavera-verano se ha establecido el cultivo de camote (Ipomoea sp.), este sistema ha permanecido alrededor de 10 años. Sin embargo, cuando las lluvias de verano han sido escasas, no se siembra el camote y se deja descansar la parcela. La preparación del terreno para la siembra del cultivo de trigo se efectúa de manera mecanizada, con arados de discos de vertedera para voltear la capa de suelo, entre 8 y 10 días después se realizan dos pasos de rastra con un arado de sub-suelo. Posteriormente, se preparan surcos, de 70 a 80 cm de ancho y de 15 a 30 cm de altura, con dos o tres hileras bien definidas. El cultivo se fertiliza durante la siembra con la fórmula química 194-40-00, que corresponde a la aplicación de 300 kg de nitrato de amonio más 87 kg de superfosfato de calcio triple y al primer riego de auxilio con 220 kg de urea. No se aplica materia orgánica.
Recolección de muestras y análisis químico de los suelos
Durante marzo de 2018 (estación seca) en cada parcela se tomaron al azar cinco muestras de suelo (cada una de 1 kg) del horizonte superior (0-15 cm de profundidad). Las muestras se mezclaron y homogenizaron para formar una muestra compuesta de 5 kg de suelo por parcela.
De cada parcela se tomó una submuestra de suelo de 1 kg que fue tamizada (≤ 2 mm) y se midió el pH (1:2 agua), nitrógeno (Microkjendhal), fósforo (Bray) y materia orgánica (Walkey-Black). Las determinaciones se realizaron de acuerdo con las metodologías presentadas en la Norma Oficial Mexicana (2002).
Extracción de esporas
Para separar las esporas se tomaron cinco submuestras de 30 g de la muestra compuesta de cada parcela (5 kg). La extracción se efectuó por la técnica de tamizado húmedo y decantación (Gerdemann y Nicolson, 1963), seguido de centrifugación (900 g) en sacarosa al 60 % (p/v). Finalmente la sacarosa se decantó y las esporas se lavaron con agua para eliminar la sacarosa. Las esporas obtenidas en cada submuestra se agruparon en morfoespecies y se colocaron en portaobjetos para elaborar preparaciones permanentes con alcohol polivinílico-lacto-glicerol y alcohol polivinílico-lactoglicerol más reactivo de Melzer en proporción 1:1 (INVAM, 2017).
La determinación taxonómica de los HMA se efectuó mediante el análisis de las
características morfológicas y subcelulares de las esporas como: color, tamaño,
hifa de sostén, estructura de la pared, tipo de ornamentación y reacción de las
capas de la pared al reactivo de Melzer (INVAM,
2017). Para la identificación de las especies, las características
morfológicas se compararon con descripciones del listado de especies reportadas
a nivel mundial para Glomeromycota conocidas y disponibles a través de enlaces
en los sitios Web: http://invam.caf.wvu.edu/
(INVAM, 2017), http://glomeromycota.wixsite.com/lbmicorrizas
(Goto y Jobim, 2020) y http://www.amf-phylogeny.com/species. Los caracteres de las
esporas se observaron con un micros-copio óptico Nikon Eclipse H550L y se
registraron en fotomicrografías. El tamaño de las esporas, diámetros de las
hifas y grosor de las capas de la pared se obtuvieron con el programa G-Capture
Pro-7, el software está integrado al microscopio. La diversidad se calculó
mediante el índice de Shannon-Wiener (Magurran,
1988) de acuerdo a la siguiente fórmula:
Resultados y discusión
El análisis químico mostró valores de pH de fuertemente ácido a moderadamente ácido, con contenido de materia orgánica muy bajo y concentración alta de fósforo y de media a alta de nitrógeno (Tabla 1).
Tabla 1 Características del suelo en las parcelas muestreadas
| Parcelas | N | P | pH | MO % |
| mg Kg-1 | mg Kg-1 | |||
| Potrero de Ramos | 30.19 | 40 | 4.02 | 3.47 |
| Potrero la Abundancia | 29.96 | 39 | 5.7 | 2.21 |
| San Carlos | 32.01 | 30 | 5.5 | 3.65 |
| El Charco | 30.28 | 40 | 5.01 | 3.18 |
| El Cuervo | 32.86 | 39 | 5.06 | 2.74 |
| Las Víboras | 29.01 | 39 | 4.7 | 2.01 |
| La Cruz | 30.01 | 42 | 5.01 | 2.21 |
| El Cazcorvo | 31.18 | 40 | 5.0 | 2.41 |
| El Calicanto | 30.21 | 41 | 4.9 | 2.33 |
| El Cisne | 29.12 | 42 | 5.07 | 2.14 |
Las esporas de HMA se encontraron en la rizósfera de plantas de trigo en todos los sitios de muestreo (Tabla 2). En total se registraron nueve morfoespecies, ocho se identificaron al nivel de especie, y una no fue identificada: seis se ubicaron en el Orden Glomerales y dos especies en el Orden Diversisporales, no se encontraron representantes de los Órdenes Archaeosporales y Paraglomerales. Del Orden Glomerales en la Familia Claroideoglomeraceae, se identificó a Claroideoglomus etunicatum (W.N. Becker & Gerd) C. Walker & A. Schüβler; en la familia Glomeraceae, se encontró a Funneliformis mosseae (T.H. Nicolson & Gerd) C. Walker & A. Schüßler; Rhizophagus intraradices (N.C. Schenck & G.S. Sm.) Sieverd., G.A. Silva & Oehl; Sclerocystis sinuosa Gerd. & B.K. Bakshi, y Septoglomus constrictum (Trappe) Sieverd., G.A. Silva & Oehl. Del Orden Diversisporales, en la familia Diversisporaceae se identificó a Diversispora spurca (C.M. Pfeiff., C. Walker & Bloss) C. Walker & A. Schüßler y Sieverdingia tortuosa Blaszk. Niezgoda, B.T.Goto; con Orden y familia inciertos se identificó a Entrophospora infrequens (I.R. Hall) R.N. Ames & R.W. Schneid (Figura 1).
Tabla 2 Presencia y ausencia de hongos micorrizógenos arbusculares (HMA) identificados en la rizósfera de monocultivos de trigo, en diez parcelas del municipio de Sixto Verduzco, Michoacán, México
| Sitios de Colecta | Especies de HMA identificadas | |||||||
| Claroideo- glumus etunicatum | Sieverdingia tortuosa | Septoglomus constrictum | Funneliformis mosseae | Rhizophagus intraradices | Sclerocystis sinuosa | Entrophospora infrequens | Diversispora spurca | |
| Potrero de Ramos | X | - | - | X | - | - | - | X |
| Potrero la Abundancia | X | - | - | - | X | - | X | X |
| San Carlos | - | - | X | X | X | X | - | X |
| El Charco | - | - | - | X | X | - | - | X |
| El Cuervo | - | - | - | X | - | - | - | - |
| Las Víboras | - | - | - | X | - | - | - | - |
| La Cruz | - | - | - | X | - | - | - | - |
| El Cazcorvo | - | - | - | X | - | - | - | - |
| El Calicanto | - | X | X | X | X | - | - | - |
| El Cisne | - | - | - | - | - | - | X | X |
(X) = Presencia de esporas. (-) = Ausencia de esporas
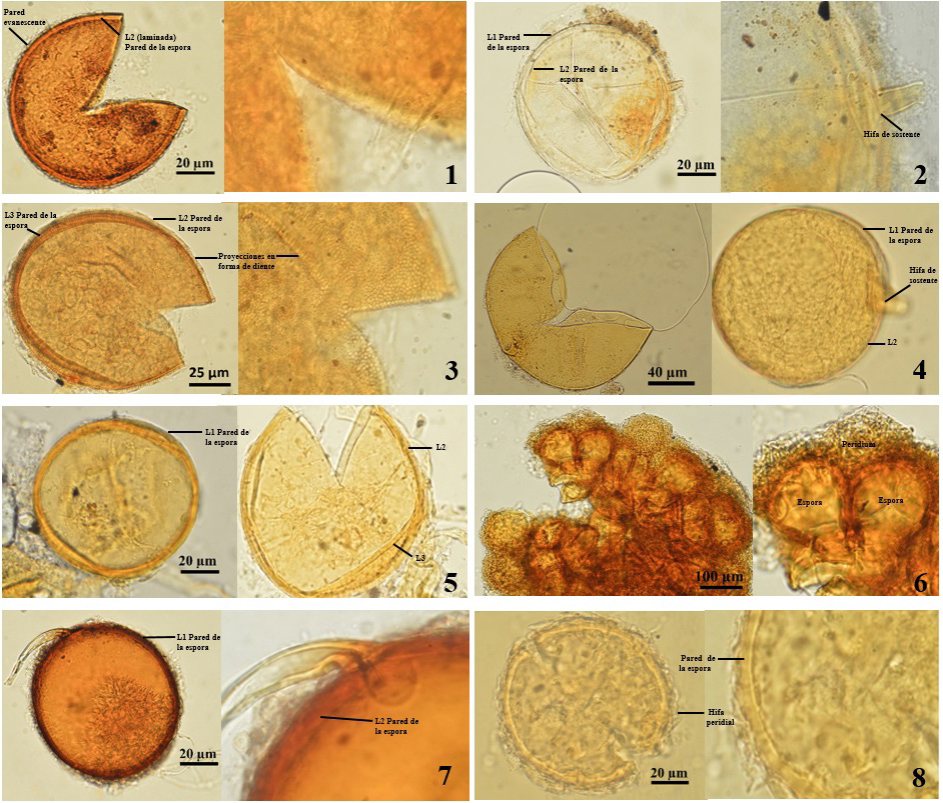
Figura 1 Especies de HMA identificadas en monocultivos de trigo en parcelas del municipio de Sixto Verduzco, Michoacán, México. 1: Claroideoglomus etunicatum. 2: Diversispora spurca. 3: Entrophospora infrequens. 4: Funneliformis mosseae. 5: Rhizophagus intraradices. 6: Sclerocystis sinuosa. 7: Septoglomus constrictum. 8: Sieverdingia tortuosa.
Estos resultados confirman la presencia de otras siete especies de HMA asociadas al trigo, ya que en este cultivo sólo se han reportado a las especies Glomus mosseae (Funneliformis mosseae), Scutellospora pellucida y Scutellospora heterogama (Menéndez et al., 2001) y a los géneros Acaulospora, Archaeospora, Entrophospora, Gigaspora, Glomus y Scutellospora (Menéndez et al., 2001; Schalamuk et al., 2006).
Contrario a lo encontrado en monocultivos de trigo, en maíz (Zea mays L.), aguacate (Persea americana Mill.) y café (Coffea arabica L.) se ha registrado el mayor número de especies de HMA quizá porque son agroecosistemas más estudiados con relación a estos microorganismos (Arias et al., 2012; González-Cortés et al., 2012; Lara-Chávez et al., 2013; Hernando-Posada et al., 2016; Raya et al., 2019; Bertolini et al., 2020). También se ha documentado que la labranza y el monocultivo de cereales afectan negativamente la diversidad de especies de HMA. Al respecto, se encontró mayor riqueza y abundancia de HMA en campos de pastizales y trébol rojo en comparación con parcelas cultivadas con cebada y trigo (Menéndez et al., 2001; Schalamuk et al., 2007). Ohel et al. (2003) reportan entre seis y ocho especies de HMA en suelos con labranza convencional sembrados continuamente con monocultivo de maíz, más de un ciclo de cultivo por año y con aplicación de grandes cantidades de insumos de producción como los fertilizantes.
Si bien se ha reportado que la composición de especies de HMA es fuertemente afectada por las labores de cultivo a diferencia de la labranza cero, Hendrix et al. (1990) y Schalamuk et al. (2006), indican que la ausencia de labranza no promueve una riqueza específica mayor o equidad en la distribución de las especies de HMA. McGonigle et al. (1990) demostraron que la labranza o la perturbación manual mediante pulverización mecánica del suelo no afectó la micorrización en maíz ni alfalfa en condiciones de macetas ni de campo, respectivamente. Estas observaciones comprueban que la pérdida de micorrización es atribuida a otros factores, como la fertilización inorgánica, principalmente de fósforo, ya que estos autores, a partir del suministro de 50 kg ha-1 de P registraron reducción en la colonización de HMA que fueron aún mayores a las dosis de 200 y 400 kg ha-1 de P. En nuestro estudio en el monocultivo de trigo se aplicó la dosis de fertilización inorgánica de 194-40 kg ha-1 de N y P, respectivamente, por lo que ésta pudo limitar también la diversidad y abundancia de HMA.
Por otra parte, las especies Claroideoglomus etunicatum, Funneliformis mosseae y Sieverdingia tortuosa (antes denominadas Glomus etunicatum, G. mosseae y G. tortuosum, respectivamente) se han encontrado con frecuencia en otros cultivos (Galvez et al., 2001; Oehl et al., 2003; Schalamuk et al., 2007; Raya et al., 2019). Estos HMA se han identificado desde la tundra de Alaska hasta los desiertos de Namibia (INVAM, 2017) y en diversos agroecosistemas (Menéndez et al., 2001; Pérez-Luna et al., 2012; González-Cortes et al., 2012; Raya et al., 2019), por lo que son consideradas especies generalistas de Glomeromycota. Dichas especies también han sido reportadas en el cultivo de trigo (Schalamuk et al., 2007); sin embargo, en el presente trabajo fue muy baja la dominancia y frecuencia de Claroideoglomus etunicatum y de Sieverdingia tortuosa. La especie Funneliformis mosseae fue dominante bajo estas condiciones edáficas y de monocultivo presentando el mayor número de esporas (Tabla 3).
Tabla 3 Diversidad de especies de HMA en los ejidos muestreados con monocultivo de trigo
| Especies | Número de esporas/30 g de suelo | Abundancia relativa (%) |
| Claroideoglumus etunicatum | 4 | 5.00 |
| Diversispora spurca | 11 | 13.75 |
| Entrophospora infrequens | 4 | 5.00 |
| Funneliformis mosseae | 40 | 13.75 |
| Rhizophagus intraradices | 11 | 50.00 |
| Sclerocystis sinuosa | 1 | 1.25 |
| Septoglomus constrictum | 1 | 1.25 |
| Sieverdingia tortuosa | 1 | 1.25 |
| No Identificadas | 7 | 8.75 |
Las especies Claroideoglomus etunicatum, Septoglomus constrictum, Funneliformis mosseae, Sclerocystis sinuosa, Entrophospora infrequens y Diversispora spurca se han reportado en México en agroecosistemas de aguacate, maíz y café (Varela et al., 2019).
En el presente estudio se encontró que la riqueza de especies de HMA y el índice de diversidad de Shannon-Wiener (1.59) son bajos; aunque nuestros valores son ligeramente más altos que los reportados en el cultivo de maíz de 1.22, 0.78, 0.88 y 0.42 (Collins et al., 1991; Serralde y Ramírez, 2004; González-Cortés et al., 2012;), pero inferiores a los encontrados en huertos de aguacate (3.192) (Raya et al., 2019). Estas variaciones en los índices de diversidad pueden estar influenciadas por la época del año en que se efectúan los muestreos de esporas, ya que el ciclo de reproducción de las especies de Glomeromycota es distinto, por lo que es importante considerar que las especies de HMA pueden esporular de manera tardía y tener mayor incidencia en los índices de biodiversidad al final del cultivo (Sieverding, 1991).
Conclusiones
Bajo las condiciones edáficas del presente estudio, en los suelos agrícolas con monocultivo de trigo se encontró diversidad baja de hongos micorrizógenos arbusculares lo que puede limitar las ventajas que estos microorganismos ofrecen a los cultivos. De las nueve especies de HMA encontradas 50 % de la abundancia relativa correspondió a Funneliformis mosseae.











 nueva página del texto (beta)
nueva página del texto (beta)



