Introducción
La enfermedad renal crónica (ERC) se encuentra entre las primeras 10 causas de mortalidad general en México y ocupa la octava causa de defunción en los varones en edad productiva y la sexta en las mujeres de 20 a 59 años1,2. Está considerada una enfermedad catastrófica debido al número creciente de casos, los altos costos de inversión3,4, los recursos de infraestructura y humanos limitados, la detección tardía y las altas tasas de morbilidad y mortalidad en los programas de sustitución5.
Los pacientes con ERC tienen una mayor incidencia de patologías oftalmológicas, como aumento de la presión intraocular (PIO), retinopatías o catarata; además, provoca en los vasos coroideos mala autorregulación y cambios en la perfusión, alterando directamente el flujo sanguíneo. Durante el tratamiento con hemodiálisis, el sistema vascular sufre una serie de cambios metabólicos que influyen en todas las estructuras vasculares, como la coroides. En el ojo, uno de los efectos más conocidos del tratamiento con hemodiálisis es una disminución de la PIO. Es claro ver que la ERC altera el sistema visual, y una de las causas es por los cambios vasculares que origina la enfermedad, entre ellos la presión coloidosmótica6.
Los cambios en la PIO por hemodiálisis se reflejan en un aumento de esta, y los valores alcanzados durante la hemodiálisis varían según los diferentes estudios. Existen registros que varían entre menos del 10% y casi el 100% de los pacientes con incremento de la PIO. Asimismo, los valores de aumento también han sido muy diferentes, entre 4 y 13 mmHg7,8. Se ha reportado que los pacientes en quienes la PIO aumenta por encima de valores normales (entre 5 y 8 mmHg) son aquellos que tienen algún tipo de alteración en la vía de excreción del humor acuoso9. También se ha señalado que, en los pacientes con tratamiento crónico, se producirían alteraciones trabeculares por depósitos patológicos a nivel trabecular, lo que explicaría el aumento de la PIO después de realizar el procedimiento10-12.
El espesor coroideo varía de acuerdo con la edad. Acosta et al.13 realizaron una investigación en pacientes con degeneración macular relacionada con la edad, que incluyó a un grupo de sujetos sanos mayores de 60 años, con una media de 70.56 ± 6.6 años, y el espesor coroideo promedio central fue de 234.9 ± 94 μm. El empleo de esta herramienta como un marcado de imagen en patología oftalmológica, incluso, la tomografía de coherencia óptica de imagen de profundidad mejorada (EDI-OCT) puede ser utilizada en el seguimiento de patologías que afectan la degeneración macular14.
Se han reportado resultados variables en cuanto a los cambios en la retina secundarios a la hemodiálisis. Los cambios en el polo posterior secundarios a la hemodiálisis incluyen cambios en la capa de fibras nerviosas, en el grosor retiniano y en el grosor coroideo. Existen muchas diferencias entre estos parámetros según publicaciones anteriores15-17. Durante la hemodiálisis, los cambios en los estados hemodinámicos pueden afectar el grosor de la coroides por medio de la redistribución del fluido y el cambio de la presión osmótica coloidal del plasma a través de las paredes de los vasos. Debido a que el suministro de sangre del ojo se deriva de la arteria oftálmica, uno ingresa a la úvea nasalmente y otro temporalmente a lo largo del meridiano horizontal del ojo cerca del nervio óptico, la medición del grosor coroideo que centra el disco óptico puede ser más significativa. Kim et al.18, en el año 2012, afirmaron que el grosor de la coroides subfoveal era un indicador indirecto del estado de perfusión ocular subfoveal.
El primer estudio para examinar los cambios en el espesor coroideo subfoveal y la densidad coroidea mediante Tomografía de Coherencia Óptica de Dominio Espectral (OCT - SD) antes y después de la hemodiálisis fue un estudio piloto que incluyó nueve pacientes con enfermedad renal crónica terminal (ERCT) candidatos a hemodiálisis. Jung et al.19 estudiaron 18 ojos y las mediciones de la EDI-OCT se realizaron 1 hora antes y 1 hora después de la hemodiálisis. La media del espesor coroideo subfoveal en todos los ojos aumentó de 276.94 ± 58.73 a 288.29 ± 65.57 mm (p = 0.003). En el estudio realizado por Yang et al.20 en 2013 en una unidad de diálisis del Hospital Gangneung Asan, en Corea del Sur, se compararon los cambios en el grosor coroideo, la PIO y otros parámetros de la OCT en una muestra de 34 ojos de 34 pacientes con ERCT, 9 de ellos con diagnóstico de diabetes tipo 2. A todos los pacientes se les realizó OCT antes y después de la hemodiálisis, y también se les midió la PIO con tonometría de aplanación de Goldmann antes y después de la hemodiálisis. El espesor promedio de la coroides disminuyó de 233.1 ± 77.5 a 219.1 ± 76.8 mm (p < 0.001), y la PIO media disminuyó de 15.1 ± 2.6 a 13.9 ± 2.2 mmHg después de la hemodiálisis (p = 0.044). Los parámetros que no se afectaron por la hemodiálisis fueron el grosor de la capa de fibras nerviosas retiniana peripapilar y el volumen macular20.
Ulaş et al.16 reportaron que hubo una disminución significativa en el grosor coroideo subfoveal, temporal y nasal, y en la PIO, pero ningún cambio en el grosor de la retina ni en el grosor central de la córnea, en su investigación que incluyó a 21 pacientes de 46 a 80 años de edad. Los espesores coroideos medios antes de la hemodiálisis en las localizaciones subfoveal, temporal y nasal fueron 99.41 ± 30.80, 94.00 ± 31.03 y 96.77 ± 26.78 µm, respectivamente. Los espesores coroideos medios después de la hemodiálisis en las localizaciones subfoveal, temporal y nasal fueron 89.64 ± 18.96, 84.27 ± 27.63 y 83.18 ± 18.00 µm en el área central, 500 µm nasal y 500 µm temporal, respectivamente. Hubo diferencias significativas entre los grosores coroideos antes y después de la hemodiálisis (p < 0.001 para todos).
El objetivo del presente estudio fue determinar los cambios del espesor coroideo en el área subfoveal, 500 mm temporal y 500 mm nasal a la fóvea, medidos por EDI-OCT en pacientes hemodializados de primera vez antes y 1 semana después del tratamiento.
Método
Estudio piloto, observacional, descriptivo, prospectivo y longitudinal, realizado en el Hospital Central Militar, en México, de septiembre a noviembre de 2018. El protocolo fue aprobado por el Comité de Investigación del mismo hospital. La presente investigación se desarrolló bajo los principios de autonomía, beneficencia y no maleficencia, de acuerdo al Reglamento de la Ley General de Salud en Materia de Investigación y bajo los lineamientos de la Declaración de Helsinki21, con consentimiento informado firmado por todos los participantes.
Se incluyeron pacientes con diagnóstico de ERCT candidatos a hemodiálisis de primera vez. Se excluyeron los pacientes con antecedente de cirugía oftalmológica en los últimos 6 meses y los pacientes con antecedente de tratamiento con láser o con antiangiogénicos intravítreos en los últimos 6 meses. Se tomaron datos sociodemograficos de edad, sexo y enfermedades crónicas, como diabetes tipo 2 e hipertensión arterial sistémica. Se utilizó muestreo no probabilístico.
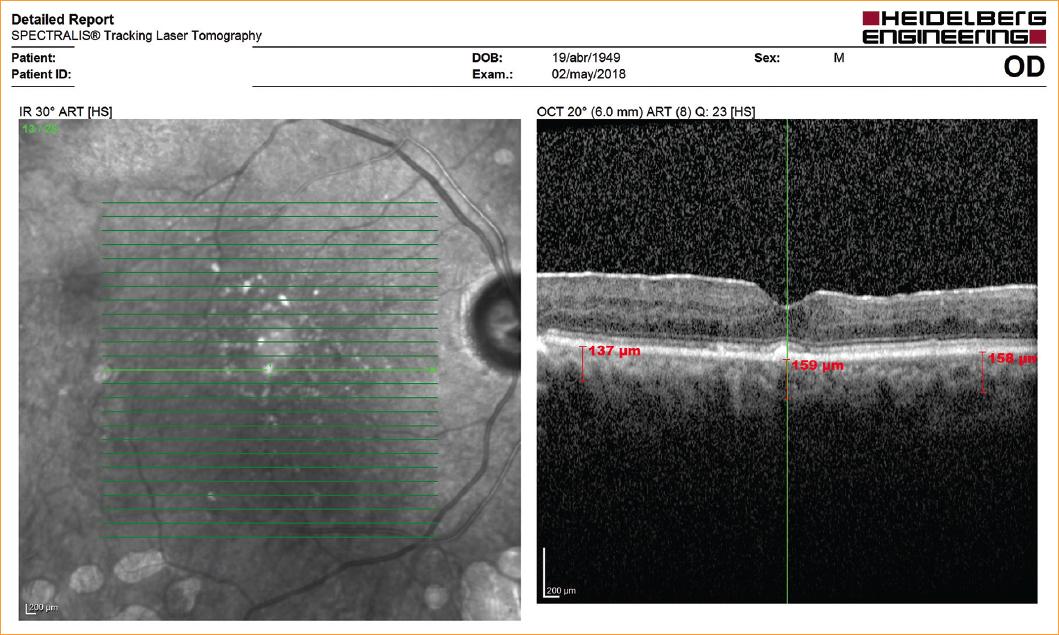
Todos los pacientes incluidos fueron evaluados oftalmológicamente previo a su primera sesión de hemodiálisis y 1 semana después de su tratamiento, incluyendo agudeza visual (AV) mediante medición decimal, biomicroscopia, PIO mediante tonometría de Goldman, funduscopia mediante oftalmoscopio indirecto y lupa aérea de 20 D. La medición del grosor coroideo se realizó mediante EDI-OCT Spectralis (Heidelberg Eng.) en el área subfoveal, 500 mm nasal y 500 mm temporal al área subfoveal. Las mediciones del grosor coroideo se realizaron de forma manual por un solo observador (Fig. 1). Los datos obtenidos se plasmaron en hojas de recolección de datos para evaluarlas posteriormente.
Cada una de las variables se analizó de acuerdo a su naturaleza y se expresó en medidas de tendencia central y dispersión para las variables cuantitativas (edad), y con medidas de frecuencias y porcentajes para las variables cualitativas.
Para conocer si había una diferencia entre las mediciones del grosor coroideo antes y después del tratamiento con hemodiálisis se realizó estadística inferencial de acuerdo con los supuestos que deben observarse previo a elegir la prueba estadística para contrastar la hipótesis. En todo caso se estableció la significancia estadística como un valor de p ≤ 0.05. El método estadístico utilizado fue la prueba U de Mann-Whitney-Wilcoxon22.
Resultados
Durante el periodo de estudio ingresaron un total de 12 pacientes (22 ojos) adultos con ERCT candidatos a hemodiálisis que cumplieron los criterios de selección. Entre los pacientes tuvo una predominancia el grupo de mayores de 60 años, con el 50% (6/12). En la tabla 1 se muestran las frecuencias con respecto al grupo de edad, y se demuestran en la figura 2.
Tabla 1 Características demográficas de los pacientes
| Características demográficas | n = 12 | % |
|---|---|---|
| Sexo | ||
| Hombres | 10 | 45.45% |
| Mujeres | 12 | 54.55% |
| Edad | ||
| < 40 años | 2 | 16.7% |
| 40-50 años | 1 | 8.3% |
| 51-60 años | 1 | 8.3% |
| > 60 años | 8 | 66.7% |
| Hipertensión arterial sistémica | ||
| Sí | 9 | 75.0% |
| No | 3 | 25.0% |
| Diabetes tipo 2 | ||
| Sí | 8 | 66.0% |
| No | 4 | 34.0% |
La presencia de comorbilidad como diabetes tipo 2 e hipertensión arterial sistémica tuvo una frecuencia del 66.6% (8/12) y el 75% (9/12), respectivamente (Fig. 3).

Figura 3 Promedio de comorbilidad en los pacientes que ingresaron al estudio. DM: diabetes mellitus; HTAS: hipertensión arterial sistémica.
Los datos de las variables AV, PIO, valores registrados de EDI-OCT central, 500 mm temporal y nasal, se evaluaron en los 22 ojos de los pacientes. De la AV se obtuvieron valores previos y posterior al tratamiento con hemodiálisis de forma variable, y sin variación mayor de 2 líneas de visión, como se muestra en la tabla 2. El promedio de las AV se representa en la figura 4.
Tabla 2 Comparación de los valores de agudeza visual en los pacientes que ingresaron al estudio, medidos en escala decimal, previo y posterior al tratamiento con hemodiálisis
| Ojo | AV previa | AV posterior |
|---|---|---|
| 1 | 0.5 | 0.5 |
| 2 | 0.5 | 0.5 |
| 3 | 0.2 | 0.5 |
| 4 | 0.1 | 0.5 |
| 5 | 0.32 | 0.32 |
| 6 | 0.32 | 0.32 |
| 7 | 0.4 | 0.4 |
| 8 | 0.63 | 0.5 |
| 9 | 0.5 | 0.4 |
| 10 | 0.63 | 1 |
| 11 | 0.63 | 1 |
| 12 | 0.8 | 0.63 |
| 13 | 0.63 | 0.5 |
| 14 | 0.8 | 0.63 |
| 15 | 0.8 | 0.63 |
| 16 | 0.63 | 0.5 |
| 17 | 0.63 | 0.8 |
| 18 | 0.025 | 0.05 |
| 19 | 0.5 | 0.63 |
| 20 | 0.4 | 0.5 |
| 21 | 0.025 | 0.05 |
| 22 | 0.15 | 0.15 |
AV: agudeza visual.

Figura 4 Promedio de agudeza visual en los pacientes que ingresaron al estudio, medida en escala decimal, previo y posterior al tratamiento con hemodiálisis.
Los valores de la PIO antes del tratamiento de hemodiálisis fueron de 13.09 ± 1.87 mmHg, con un mínimo de 10 mmHg y un máximo de 18 mmHg. Una semana posterior al tratamiento de hemodiálisis, los valores promedio de la PIO fueron de 12.77 ± 1.79 mmHg, sin cambios en los valores máximos y mínimos, como puede verse en la tabla 3. Mediante la prueba U de Mann-Whitney pareada se compararon los resultados posterior a la hemodiálisis (Fig. 5).
Tabla 3 Comparación de los valores de presión intraocular de los pacientes que ingresaron al estudio, previo y posterior al tratamiento con hemodiálisis
| Ojo | PIO previa (mmHg) | PIO posterior (mmHg) |
|---|---|---|
| 1 | 11 | 12 |
| 2 | 12 | 12 |
| 3 | 12 | 12 |
| 4 | 12 | 12 |
| 5 | 16 | 16 |
| 6 | 16 | 18 |
| 7 | 15 | 18 |
| 8 | 16 | 18 |
| 9 | 12 | 12 |
| 10 | 12 | 12 |
| 11 | 14 | 12 |
| 12 | 10 | 10 |
| 13 | 12 | 12 |
| 14 | 12 | 12 |
| 15 | 12 | 12 |
| 16 | 13 | 12 |
| 17 | 14 | 12 |
| 18 | 13 | 13 |
| 19 | 16 | 12 |
| 20 | 12 | 12 |
| 21 | 12 | 12 |
| 22 | 12 | 12 |
PIO: presión intraocular.
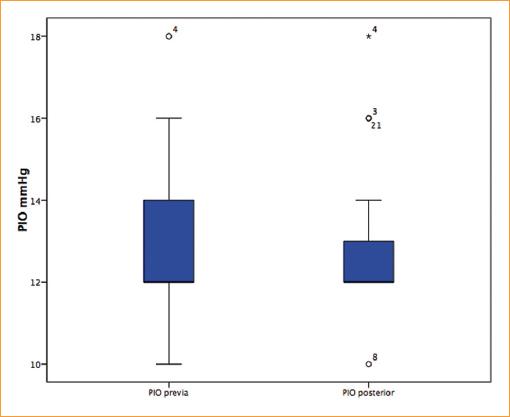
Figura 5 Promedio de cambios en la presión intraocular (PIO) en los pacientes hemodializados que ingresaron al estudio, medido previo y posterior al tratamiento con hemodiálisis.
El promedio del espesor coroideo 1 semana antes del tratamiento con hemodiálisis medido por EDI-OCT fue de 99.41 ± 30.80, 94.00 ± 31.03 y 96.77 ± 26.78 mm en el área central, 500 mm nasal y 500 mm temporal, respectivamente; se muestran detallados en la tabla 4. Una semana posterior al tratamiento de hemodiálisis se obtuvieron promedios de 89.64 ± 18.96, 84.27 ± 27.63 y 83.18 ± 18.00 mm en el área central, 500 mm nasal y 500 mm temporal, respectivamente (Figs. 6, 7 y 8). En la tabla 5 se muestran los valores detallados. La totalidad de las mediciones obtenidas, tanto previo como posterior a la hemodiálisis, se detallan en la tabla 6.
Tabla 4 Promedio del espesor coroideo medido por EDI-OCT en el área subfoveal, 500 µm nasal y temporal, de los pacientes previo al tratamiento de hemodiálisis
| Espesor coroideo (EDI-OCT) | Central previo (µm) | 500 µm temporal previo (µm) | 500 µm nasal previo (µm) |
|---|---|---|---|
| Media | 99.41 | 96.77 | 94.00 |
| Mediana | 88.00 | 90.50 | 86.00 |
| Moda | 85.00 | 90.00 | 85.00 |
| DE | 30.80 | 26.78 | 31.03 |
| Mínimo | 62.00 | 66.00 | 47.00 |
DE: desviación estándar.

Figura 6 Promedio de mediciones del espesor coroideo por EDI-OCT a nivel subfoveal, previo y posterior al tratamiento con hemodiálisis.
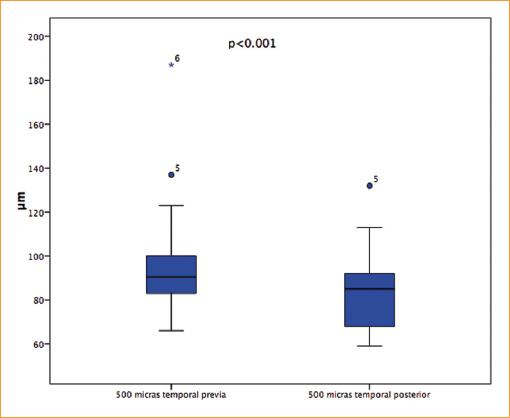
Figura 7 Promedio de mediciones del espesor coroideo por EDI-OCT a nivel de 500 µm temporal a la fóvea, previo y posterior al tratamiento con hemodiálisis.

Figura 8 Promedio de mediciones del espesor coroideo por EDI-OCT a nivel de 500 µm nasal a la fóvea, previo y posterior al tratamiento con hemodiálisis.
Tabla 5 Promedio del espesor coroideo medido por EDI-OCT en el área subfoveal, 500 µm nasal y temporal, de los pacientes posterior al tratamiento de hemodiálisis
| Espesor coroideo (EDI-OCT) | Central Posterior (µm) | 500 µm temporal posterior (µm) | 500 µm nasal posterior (µm) |
|---|---|---|---|
| Media | 89.64 | 83.18 | 84.27 |
| Mediana | 87.50 | 85.00 | 81.00 |
| Moda | 82.00 | 85.00 | 69.00 |
| DE | 18.96 | 18.00 | 27.63 |
| Mínimo | 59.00 | 59.00 | 45.00 |
| Máximo | 135.00 | 132.00 | 154.00 |
DE: desviación estándar.
Tabla 6 Totalidad de mediciones del espesor coroideo por EDI-OCT en el área subfoveal, 500 µm nasal y temporal, de los pacientes previo y posterior al tratamiento de hemodiálisis
| Ojo | Grosor coroideo previo (µm) | Grosor coroideo posterior (µm) | ||||
|---|---|---|---|---|---|---|
| Subfoveal | Nasal | Temporal | Subfoveal | Nasal | Temporal | |
| 1 | 90 | 69 | 70 | 88 | 67 | 65 |
| 2 | 69 | 76 | 84 | 66 | 75 | 79 |
| 3 | 69 | 66 | 77 | 76 | 70 | 54 |
| 4 | 75 | 83 | 56 | 82 | 59 | 60 |
| 5 | 85 | 91 | 47 | 69 | 61 | 45 |
| 6 | 76 | 92 | 85 | 87 | 90 | 82 |
| 7 | 62 | 90 | 85 | 59 | 85 | 50 |
| 8 | 159 | 137 | 158 | 114 | 132 | 154 |
| 9 | 191 | 187 | 161 | 95 | 85 | 86 |
| 10 | 118 | 100 | 151 | 115 | 92 | 110 |
| 11 | 107 | 121 | 104 | 106 | 113 | 98 |
| 12 | 100 | 90 | 98 | 82 | 67 | 97 |
| 13 | 102 | 83 | 60 | 93 | 78 | 57 |
| 14 | 85 | 100 | 87 | 78 | 68 | 69 |
| 15 | 85 | 86 | 80 | 71 | 85 | 80 |
| 16 | 106 | 99 | 96 | 116 | 99 | 136 |
| 17 | 130 | 123 | 125 | 135 | 102 | 118 |
| 18 | 86 | 90 | 88 | 92 | 88 | 86 |
| 19 | 117 | 102 | 108 | 95 | 92 | 98 |
| 20 | 115 | 98 | 101 | 101 | 89 | 92 |
| 21 | 78 | 71 | 75 | 75 | 65 | 69 |
| 22 | 82 | 75 | 72 | 77 | 68 | 69 |
Para identificar algún cambio en el espesor coroideo se utilizó la prueba U de Mann-Whitney pareada, con los resultados que se muestran en la tabla 7.
Table 7 Prueba U de Mann-Whitney para las comparaciones de los valores de EDI-OCT a nivel central, 500 µm temporal y 500 µm nasal
| Pares | Mediana | Media | n | DE | p |
|---|---|---|---|---|---|
| Central previa | 88.0 | 100.80 | 22 | 32.04 | 0.055 |
| Central posterior | 87.5 | 90.55 | 22 | 19.34 | |
| 500 µm temporal previa | 90.5 | 97.40 | 22 | 28.08 | < 0.001 |
| 500 µm temporal posterior | 85.0 | 84.05 | 22 | 18.17 | |
| 500 µm nasal previa | 86.0 | 96.65 | 22 | 30.64 | 0.002 |
| 500 µm nasal posterior | 81.0 | 86.15 | 22 | 27.54 |
DE: desviación estándar.
Se obtuvieron valores de p = 0.055 en el área subfoveal (Fig. 6), p < 0.001 en el área de 500 mm temporal a la fóvea (Fig. 7) y de p = 0.002 en el área de 500 mm nasal a la fóvea (Fig. 8).
Discusión
Desde la aparición y el acceso a las nuevas tecnologías aplicadas a la oftalmología, la EDI-OCT se ha convertido en una herramienta ampliamente utilizada para la valoración de la retina y la coroides23, pero aún no es accesible a toda la población. Sin embargo, en esta investigación se destaca su utilidad en pacientes con ERCT, y que junto a un examen clínico oftalmológico puede contribuir a una mejora en la atención24,25.
Se ha descrito que las complicaciones oftalmológicas son más comunes en los pacientes con ERCT que en la población general26. Nuestra investigación, con una muestra pequeña de pacientes candidatos a tratamiento de hemodiálisis, nos permitió observar que en su mayoría se encontraban en rangos de una AV adecuada, de 20/20 a 20/40 (ocho ojos); la deficiencia visual > 20/200 estuvo presente en seis ojos previo al inicio de tratamiento y tras 1 semana del tratamiento se presentó en cinco ojos. Los cambios en la AV antes y después del tratamiento con hemodiálisis no fueron estadísticamente significativos (p = 0.343). Ghasemi et al.27, en una muestra de 130 ojos, encontraron que la AV mejoró posterior al tratamiento con hemodiálisis. Probablemente con una muestra mayor se pueda observar si hay cambios en la AV de nuestros pacientes, ya que de manera general se observó que 1 semana después del tratamiento con hemodiálisis algunos ojos cambiaron de categoría de la AV para situarse en una con menor afectación.
La hemodiálisis causa un cambio en los parámetros de la composición y el volumen del plasma que puede afectar la dinámica y la composición del fluido ocular, la coroides. Al analizar los cambios en la PIO en pacientes candidatos a tratamiento con hemodiálisis antes y después del tratamiento con hemodiálisis, al igual que en el estudio de Ulaş et al.16, la PIO no tuvo cambios significativos, mostrando valores previos al tratamiento de hemodiálisis y 1 semana después de 13.09 ± 1.87 y 12.77 ± 1.79 mmHg (p = 0.379). En la investigación de Ulaş et al.16 se observaron PIO antes y después de 16.8 ± 03.0 y 16.7 ± 03.6 mmHg (p = 0.540). Yang et al.20 reportaron una disminución en la PIO de 15.1 ± 2.6 a 13.9 ± 2.2 mmHg después de la hemodiálisis (p = 0.044). En nuestra investigación se observó una tendencia posterior al tratamiento de hemodiálisis a presiones de 12 mmHg, con ojos en los que no tuvieron cambios (ojo 4). Estas variaciones de la PIO posterior al tratamiento de hemodiálisis no tuvieron significancia estadística muy probablemente por el tamaño de la muestra.
Uno de los primeros estudios realizado para evaluar los cambios del espesor coroideo fue el de Jung et al.19, quienes informaron que el grosor coroideo aumentó después de una sesión de hemodiálisis. Estos investigadores realizaron la medición del grosor coroideo 1 hora después de la hemodiálisis, y propusieron que el aumento del grosor coroideo pueda deberse a un control autorregulador hemodinámico ocular. Por otro lado, Ulaş et al.16, Yang et al.20 y Kal et al.28 informaron una disminución significativa en el grosor coroideo después de la hemodiálisis, afirmando que la hipovolemia, así como los cambios en la presión osmótica coloidal, producen una reducción del lecho vascular coroideo que influye en su grosor. Nuestros resultados son similares a los de estos estudios.
Una semana previa al tratamiento de hemodiálisis, los valores del espesor coroideo en el área central, subfoveal, 500 mm temporal y 500 mm nasal, fueron 99.40 ± 30.80, 96.77 ± 26.78 y 94.00 ± 31.03 mm, respectivamente, y 1 semana después del tratamiento con hemodiálisis tuvieron una reducción con valores 89.63 ± 18.96, 83.18 ± 18.00 y 84.27 ± 27.62 mm, respectivamente, a excepción del grosor coroideo central (p = 0.055). Kal et al.28 también documentaron una reducción del espesor coroideo en una muestra de 25 pacientes en los que solo fue medido un ojo; utilizaron tres mediciones de EDI-OCT durante el tratamiento de la hemodiálisis y las localizaciones de las mediciones fueron 1500 mm temporal de la fóvea y 500 mm nasal a la fóvea. Yang et al.20, en una muestra de 34 ojos de 34 pacientes, reportaron una disminución del espesor promedio de la coroides de 233.1 ± 77.5 a 219.1 ± 76.8 mm (p < 0.001). Ulaş et al.16, en una muestra de 21 pacientes entre 46 y 80 años, encontraron que el grosor coroideo medido antes de la hemodiálisis en las localizaciones subfoveal, temporal y nasal fue de 232.81 ± 71.92, 212.43 ± 70.50 y 182.14 ± 68.88 mm, respectivamente, y posterior al tratamiento con hemodiálisis fue de 210.90 ± 65.53, 195.38 ± 66.48 y 165.19 ± 66.73 mm, respectivamente; todas las mediciones con diferencias significativas (p < 0.001).
Algo que llama la atención en nuestros pacientes es el grosor del espesor coroideo relativamente menor que lo descrito por otros autores, ya que se trata de pacientes con ERCT de grupos de edad similares a los de la muestra de Ulaş et al.16 (46 a 80 años).
Nuestra investigación demuestra de manera indirecta el resultado de los cambios en el flujo sanguíneo que afectan el grosor de la coroides.
Conclusiones
Los cambios en el espesor coroideo del área central medidos por EDI-OCT en pacientes hemodializados del Hospital Central Militar 1 semana después del inició del tratamiento de hemodiálisis son una disminución del espesor coroideo a 500 mm temporal y 500 mm nasal. No existen cambios en la PIO ni en la AV en los pacientes candidatos a tratamiento con hemodiálisis entre antes y después del tratamiento con hemodiálisis. La presente investigación es un estudio piloto, que aun con el pequeño tamaño de muestra hizo evidente el cambio en el espesor coroideo a nivel 500 mm temporal y 500 mm nasal, pero no así en la medición del espesor coroideo central, la AV y la PIO. Se propone que se continúe con la investigación a fin de integrar un número mayor de pacientes para evidenciar los cambios en las variables que no fueron significativas y poder hacer conclusiones firmes con respecto a estas variables (AV, PIO y espesor coroideo central). Este estudio es una base inicial para la implementación de nuevos proyectos de investigación al respecto, que permitan generar evidencia en la toma de decisiones clínicas. En lo que respecta a los pacientes con ERCT candidatos a hemodiálisis se sugiere incluir una valoración oftalmológica para detección de patologías asociadas, no solo para detectar cambios coroideos sino todas las patologías oftalmológicas y poder instaurar un tratamiento precoz.











 nueva página del texto (beta)
nueva página del texto (beta)