Introducción
Vitis vinifera es la especie de vid de mayor importancia económica para la vi- ticultura a nivel mundial, y la única extensivamente utilizada en la producción de vino (This et al., 2006; Sargolzaei et al., 2021). En la actualidad, el mercado vití- cola mundial genera alrededor de USD $34 billones (Sacchi, 2021). Para el 2018, la extensión global aproximada fue de 7,4 millones de hectáreas, con una produc- tividad estimada de 77,8 millones de toneladas; del total, el 57 % fue destinado a la vinicultura, el 36 % para consumo fresco, y el 7 % para pasas (Organización Internacional de la Viña y el Vino [OIV], 2019). Aunque existen más de 10000 va- riedades, solo 33 cubren más del 50 % del área cultivada total (OIV, 2017).
Ante las variaciones en los regímenes hídricos y de temperatura, por efecto del cambio climático, Lallanilla (2013) y Santos et al. (2020a) advierten que la distri- bución geográfica de la viticultura se transformará en los próximos 50 años. Pese a la plasticidad que exhibe V. vinifera en la aclimatación a diversas condiciones ambientales, algunas áreas que se consideran aptas para el cultivo podrían perder la capacidad, lo que dificultaría el establecimiento y mantenimiento de los viñedos (This et al., 2006; Jacinto et al., 2023).
Según exponen Mozell y Thach (2014), es posible que este panorama provoque una migración de la actividad vitícola en Norteamérica, Europa y Sudamérica, ha- cia regiones más altas y frías, y una disminución en Australia y Sudáfrica, como consecuencia de las altas temperaturas; en contraste, China destaca como el único país con potencial crecimiento en esta industria. Esta proyección representa un desafío para la vinicultura, puesto que algunos criterios de calidad del vino están asociados a características determinadas por la región de la cual procede (Macken- zie y Christy, 2005; Moriondo et al., 2013).
Vitis vinifera fue introducida a América Latina durante el siglo XVI (Camargo et al., 2008), y la viticultura se ha documentado desde hace más de 60 años en países tropicales. Sin embargo, la producción en los trópicos se ha caracterizado por ser de menor calidad para la vinificación, pues la adaptación de las variedades de clima templado en condiciones tropicales es difícil, lo que afecta el desarrollo del cultivo (Carbonneau, 2011; Camargo et al., 2012; Commins et al., 2012; Hannah et al., 2013). Las principales causas de estas alteraciones son:
en zonas tropicales, las yemas no presentan dormancia, y con suficiente agua y nutrientes, la vid crece ininterrumpidamente, lo cual causa un vigor excesivo, pobre lignificación, heterogeneidad en la brotación y rendimientos irregulares entre ciclos (Tonietto y Pereira, 2011; Ashenfelter y Storchmann, 2014; Demir, 2014; Khalil-Ur-Rehman et al., 2017);
las altas temperaturas durante todo el ciclo vegetativo aceleran el crecimiento y adelantan los eventos fenológicos, aparte de reducir la fertilidad de las yemas para el ciclo siguiente (Carbonneau, 2011; Demir, 2014; Leão et al., 2016);
las altas temperaturas durante la maduración de las uvas provocan que estas presenten un mayor contenido de azúcares, menor acidez, y un metabolismo de fenoles incompleto (Tonietto y Pereira, 2011; Hickey et al., 2018; Costa et al., 2019; Fonseca et al., 2023);
el excesivo crecimiento vegetativo favorece la susceptibilidad al ataque de pa- tógenos, y la alta temperatura y humedad son propicias para el progreso de en- fermedades como el mildiú velloso (Camargo et al., 2012; Nascimento-Gavioli, et al., 2020), lo que exige una adecuada selección de la época y sistema de siembra, basados en las condiciones climáticas del sitio (de Bem et al., 2016).
Estos efectos latitudinales sobre el desarrollo de la vid limitan la productividad de los viñedos tropicales (Ashenfelter y Storchmann, 2014), y la tecnificación de los sistemas de producción requerida para producir uvas de alta calidad es costo- sa (Tonietto y Pereira, 2011; Camargo et al., 2012). No obstante, el interés en la viticultura tropical ha crecido recientemente, pues ante la ausencia de un periodo de descanso, las plantas crecen de forma continua, de manera que, con variedades adaptadas, sumado a un correcto manejo de la arquitectura del dosel, podas e irri- gación, pueden obtenerse dos o más ciclos por año (Camargo, 2005; Mosedale et al., 2016; Nassur et al., 2017).
Las alteraciones en la temperatura y precipitación también constituyen facto- res determinantes en los patrones de distribución de las enfermedades de diversos cultivos, así como repercusiones en la eficacia de los genes de resistencia a estos patógenos (Garrett et al., 2006; Tylianakis et al., 2008). En este sentido, Leis et al. (2018) indican que, en Europa, la viticultura podría verse amenazada por un incre- mento en la presión de enfermedades, entre las cuales el mildiú velloso, causado por el oomicete Plasmopara viticola, se proyecta con un aumento de 5 a 20 % en el potencial de infección (Bregaglio et al., 2013). Esta enfermedad constituye uno de los problemas fitosanitarios de mayor importancia económica en la viticultura, por lo tanto, resulta necesario contar con alternativas efectivas para enfrentar futuras dinámicas de las epidemias en diversos escenarios.
Cultivo de la vid en Costa Rica
En 1945, el Dr. Joseph L. Fennell manifestó su interés por desarrollar híbridos para vino y uva fresca, a partir de cruces entre especies silvestres provenientes de bosques tropicales y variedades importadas, que pudieran adaptarse a los climas cálidos y húmedos, y, eventualmente, cultivarse a gran escala (Fennell, 1945; Cruz, 1948). Sin embargo, fue hasta inicios de 1970s que se establecieron las primeras plantaciones comerciales de variedades europeas en Costa Rica, localizadas en Playa Panamá, Guanacaste, aunque la susceptibilidad de estas variedades a la enfermedad de Pierce (Xylella fastidiosa), así como la ausencia de información técnica, afectaron la evolución del proyecto (Sheng-Pin, 1988).
En 1985, un programa cooperativo entre el Ministerio de Agricultura y Ganade- ría (MAG), el Instituto Nacional de Aprendizaje (INA), el Instituto de Desarrollo Agrario (IDA) y la Misión Técnica Agrícola de la República de China, convinieron en evaluar más de 75 variedades importadas de vid, para seleccionar las que mejor se adaptaran al clima tropical (Sheng-Pin, 1988). En el camino hacia el estable- cimiento del cultivar Ruby Seedless como el más promisorio en ese momento, el programa también facilitó la investigación, divulgación, capacitación y asistencia técnica, con lo cual se generó material informativo sobre el manejo agronómico de la vid en Costa Rica (Lizano-Sáenz, 1992).
Tras la fundación de la Asociación de Productores de Uva de Costa Rica, en 1997, los materiales vegetales se probaron en otras zonas de Costa Rica durante varios años, hasta que, en el 2006, la Misión Técnica Agrícola de la República de China se fue del país. Después de ese momento, varios productores se retiraron de la actividad e incluso vendieron sus fincas (Cordero-Pérez, 2022). Actualmente, el cultivo de la vid en Costa Rica se ha registrado en cinco provincias: Alajuela, Car- tago, Guanacaste, Puntarenas y San José (Cruz, 1948; Sheng-Pin, 1988; Pymes, El Financiero, 2015; Barquero, 2016; Fernández, 2016); no obstante, la actividad vi- tícola actual no es significativa, y la Encuesta Nacional Agropecuaria 2021 (INEC, 2022) no reporta datos de área ni variedades de vid sembradas en el país.
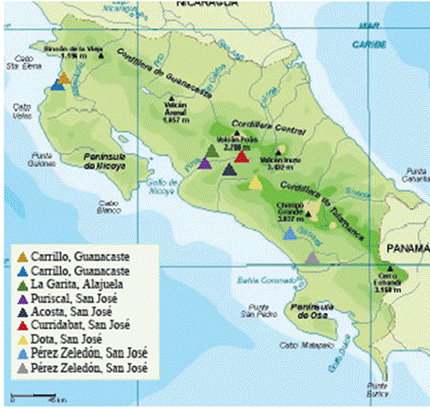
Pese a la ausencia de datos oficiales sobre el estado actual del cultivo, hay regis- tros de al menos nueve productores, ubicados en los cantones de La Garita (Alajue- la), Carrillo (Guanacaste), Acosta, Curridabat, Pérez Zeledón, Puriscal y Santa Ma- ría de Dota (San José) (Figura 1). De estas plantaciones, solo las ubicadas en La Garita y Santa María de Dota tienen una extensión superior a 2 ha. Esta última se localiza a más de 2000 m.s.n.m., la de mayor altitud y extensión en el país, con más de 10 ha cultivadas con distintas variedades de clima templado, para la producción y exportación de vino. Los demás viñedos se encuentran en zonas de clima cálido, a una altitud igual o menor a 1000 m.s.n.m.; esta condición permite que puedan obtener dos o más cosechas por año.
A nivel comercial, los viñedos en Acosta, La Garita y Santa María de Dota elaboran y tienen marcas de vino registradas. Por su parte, la plantación ubicada en Curridabat funciona como un laboratorio destinado a la mejora de variedades que puedan adaptarse al clima tropical. Las otras plantaciones representan una actividad secundaria para los productores, quienes venden las uvas para consumo fresco y, ocasionalmente, producen vino de manera artesanal.
Si bien estos antecedentes sugieren que existen posibilidades de explotar la viticultura en distintas áreas del país, la carencia de información sobre este cultivo limita la búsqueda de nuevas zonas con potencial para la actividad. Adicionalmente,
las alternativas para el manejo químico de las enfermedades son escasas, puesto que, de acuerdo con la base de datos del Servicio Fitosanitario del Estado (SFE, 2023), al momento, solo dos fungicidas están registrados para uso en la vid: miclobutanil (triazol) y mancozeb (ditiocarbamato). De estos, solo el último está registrado para combatir el mildiú velloso. Esta situación restringe la rentabilidad de los viñedos y la proyección de las pequeñas empresas para insertarse en la cadena comercial.
En Costa Rica, todos los viticultores afirman que, bajo condiciones de alta hu- medad relativa y precipitación, aparecen enfermedades que afectan sus viñedos, en- tre las cuales, el mildiú velloso es la más común; sin embargo, ninguno ha estimado las pérdidas provocadas. Otras patologías indicadas, que afectan en menor grado, son la enfermedad de Pierce (Xylella fastidiosa), la roya (Phakopsora euvitis) y el mildiú polvoso (Erysiphe necator), aunque este último solo se presenta en las plan- taciones de clima cálido; asimismo, reportan daños por plagas como el barrenador de raíz (Vitacea polistiformis), gallina ciega (Phyllophaga spp.) y la mosca de la fruta (Ceratitis capitata).
Mildiú velloso de la vid
En el mundo, la mayor parte del área cultivada para la viticultura corresponde a variedades de origen europeo (V. vinifera), pues los rendimientos son mayores y la calidad se considera superior (Sun et al., 2011; OIV, 2017; Teissedre, 2018). No obstante, las variedades de V. vinifera son altamente susceptibles a enfermedades, entre ellas, el mildiú velloso, razón por la cual representa una amenaza constante en las regiones productoras (Gessler et al., 2011; Yu et al., 2012; Wilcox et al., 2015; Ash, 2017).
El agente causal del mildiú velloso, P. viticola, es un parásito biotrófico obli- gado (Göker et al., 2007). La clasificación taxonómica lo ubica dentro del reino Chromista, filo Oomycota, clase Peronosporea, orden Peronosporales y familia Pe- ronosporaceae (Index Fungorum, 2023). Aunque no es un hongo verdadero, eco- lógica y epidemiológicamente posee un comportamiento similar (Kassemeyer et al., 2015). Este organismo es patogénico para al menos 28 especies de Vitis, de las cuales V. vinifera y V. labrusca son los hospederos principales (Rouxel et al., 2014; CABI, 2021).
Plasmopara viticola es originario de América del Norte, en donde las variedades silvestres y cultivadas de origen americano (V. labrusca) muestran distintos grados de resistencia a la infección, producto de un mayor periodo de coevolución con el patógeno (Bitsadze et al., 2014; Boso et al., 2014). A través de la importación de patrones con resistencia a la filoxera (Daktulosphaira vitifoliae), provenientes de Estados Unidos, P. viticola fue introducido al suroeste de Francia a finales de 1870s, y a partir de allí se diseminó al resto del continente, causando pérdidas signi- ficativas en los rendimientos, que se extendieron durante la primera mitad del siglo XX (Gessler et al., 2011; Fontaine et al., 2021; Koledenkova et al., 2022).
El mildiú velloso es altamente destructivo en zonas cálidas con alta precipita- ción, ya que la humedad es el factor responsable de las epidemias (Kennelly et al., 2007; Caffi et al., 2013; Koledenkova et al., 2022). Cuando las condiciones climáti- cas son favorables, y el manejo agronómico es inadecuado, esta enfermedad puede provocar pérdidas de hasta un 100 % en la producción (Ash, 2017; Buonassisi et al., 2017). Aparte de parasitar a la planta durante todo el ciclo vegetativo, cuando la infección es severa, ocurre defoliación; en consecuencia, las uvas pierden valor comercial y nutricional (Jermini et al., 2010; Taylor, 2021). Debido a una baja acumulación de carbohidratos de reserva, la defoliación también provoca pérdidas en los rendimientos de los ciclos siguientes (Matasci et al., 2008; Jackson, 2022).
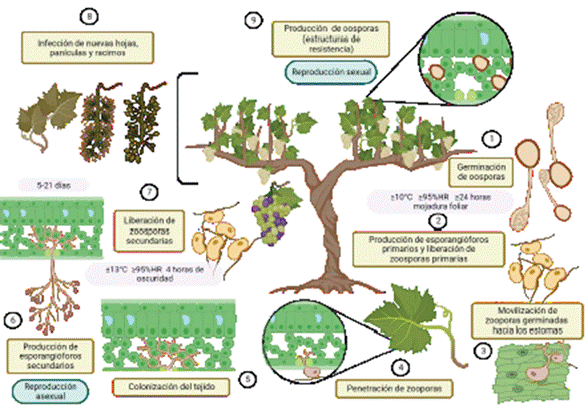
En regiones templadas, al inicio de la primavera, cuando las temperaturas exce- den los 10 ºC, la humedad relativa es mayor al 95 %, y la frecuencia de las lluvias aumenta, las oosporas, que son estructuras sexuales de sobrevivencia permanecen en el suelo y la hojarasca, germinan si una lámina de agua permanece por 24 h (CABI, 2021). A través de un tubo germinativo, se forma un macrosporangio, el cual contiene zoosporas biflageladas; estas, dispersadas por el agua de lluvia y el viento, penetran el tejido vegetal vivo, colonizan, infectan y se reproducen asexual- mente, lo cual da origen a un ciclo de infección secundario (Yin et al., 2017). Este ciclo puede completarse en cinco días (Figura 2), dependiendo de las condiciones climáticas y la susceptibilidad del hospedero (Agrios, 2005; Kortekamp, 2005).
En enfermedades policíclicas como el mildiú velloso, tanto las oosporas como las zoosporas participan en el origen de nuevas infecciones; las primeras actúan como inóculo primario, mientras que, las segundas representan el inóculo secundario (Carisse, 2016; Maddalena et al., 2021; Massi et al., 2022). En el pasado se creía que solo el inóculo secundario contribuía al progreso de las epidemias, sin embargo, la evidencia indica que las oosporas mantienen su capacidad de germinar y causar infecciones por hasta tres meses (Vercesi et al., 2010; Gessler et al., 2011; Rossi et al., 2013).
Las zoosporas son liberadas del esporangio cuando la humedad en el ambien- te es alta, y se mantienen activas por algunas horas; puesto que no poseen pared
celular, su sobrevivencia está determinada por la presencia de agua libre (Massi et al., 2022). Luego de llegar a tejido susceptible, estas células nadan en la lámina de agua sobre las hojas hasta los estomas, donde se enquistan, germinan y penetran a través de ellos, mediante la acción de enzimas degradadoras de la pared celular de la planta. En la cavidad sub-estomatal forman una vesícula, a partir de la cual las hifas se ramifican y colonizan las células del mesófilo para producir haustorios (Fröbel y Zyprian, 2019). Esta estructura se encarga de absorber los nutrientes de las células. Kassemeyer et al. (2015) indican que la esporulación ocurre bajo tem- peraturas mayores a 13 ºC, humedad relativa de 95 % y al menos 4 h de oscuridad, con lo que finaliza el periodo latente de la enfermedad.
El periodo de incubación también es influenciado por la temperatura; en prome- dio, la aparición de síntomas tarda de 7 a 10 días después del inicio de la infección, pero puede extenderse hasta 21 días (Ash, 2017). Además, este evento varía según el órgano de la planta infectado y la resistencia ontogénica expresada (Steimetz et al., 2012; Rossi et al., 2013; Buonassisi et al., 2017). Este periodo es más corto entre los 20-25 ºC y en hojas nuevas, y más largo a temperaturas menores a 12 ºC y en hojas viejas (CABI, 2021).
Las infecciones de mildiú velloso ocurren en todos los tejidos fotosintéticos de la planta (Bitsadze et al., 2014; Fröbel et al., 2019). Los síntomas iniciales apare- cen en el haz de las hojas nuevas como círculos cloróticos de aspecto grasiento, los cuales se tornan de color café conforme las lesiones envejecen (Figura 3A). Por otro lado, en las hojas viejas, las venas delimitan estas lesiones, formando pequeñas manchas angulares que crecen y coalescen hasta cubrir todo el tejido (Rossi et al., 2013; Taylor, 2021).
En los zarcillos, peciolos e inflorescencias, las infecciones causan engrosamien- to y enrollamiento de los tejidos, tras lo que se presenta necrosis (Kassemeyer et al., 2015). Asimismo, Koledenkova et al. (2022) mencionan que, en brotes y raci- mos jóvenes, el volumen de micelio intercelular provoca una deformación y hundi- miento de los tejidos, los cuales se necrosan con rapidez. Los racimos jóvenes son altamente susceptibles a la infección, pero, conforme se desarrollan, la resistencia a la enfermedad aumenta, debido a que las lenticelas en el epicarpio bloquean la pe- netración de las hifas (Carisse, 2016). No obstante, en racimos maduros, el pedicelo permanece susceptible y las uvas pueden infectarse desde allí (Gindro et al., 2022). Los esporangióforos son de color blanco, y se producen en el envés de las hojas, alrededor de las lesiones, y sobre los demás tejidos infectados (Figura 3B y 3C). Después de la esporulación, la proporción de tejido necrótico aumenta y, even- tualmente, ocurre la abscisión de los órganos afectados y la defoliación total de la planta (Taylor, 2021; Jackson, 2022).

Figure 3 Síntomas y signos característicos del mildiú velloso de la vid (Vitis vinifera) causado por el oomicete Plasmopara viticola. A. Clorosis y necrosis foliar. B. Esporulación en el envés de hojas con lesiones necróticas. C. Esporulación en frutos jóvenes. D. Necrosis foliar y pobre llenado de frutos.
Manejo del mildiú velloso
Tradicionalmente, el manejo del mildiú velloso (Figura 4) implementa prácticas agrícolas preventivas como las podas y el uso de tutores, con el propósito de pro- mover la aireación y la reducción de la humedad en el dosel, y de esta forma, evitar la producción de infecciones secundarias (Agrios, 2005; Gessler et al., 2011). A finales del siglo XIX, en Burdeos, Francia, se observó un retraso en la aparición de

Figure 4 Tácticas (ventajas y desventajas) documentadas para el manejo del mildiú velloso de la vid (Vitis vinifera), causado por el oomicete Plasmopara viticola.
síntomas al fumigar los viñedos con un compuesto elaborado a partir de sulfato de cobre e hidróxido de calcio. La mezcla se popularizó en otras regiones vitícolas del mundo, debido a la fuerte adherencia y persistencia en las plantas, con el nombre de “caldo bordelés”. Desde entonces, las sales de cobre son utilizadas para prevenir infecciones secundarias en los programas de aplicaciones químicas, con variacio- nes en la composición, dosis e intervalos de aplicación, según la presión de inóculo presente (Lamichhane et al., 2018; Massi et al., 2021).
Ante la escasez de cobre para la agricultura durante la Segunda Guerra Mun- dial, surgió la necesidad de encontrar nuevas sustancias para el combate del mildiú velloso (Lamberth, 2019). En la década de 1970s, se crearon moléculas para el control de P. viticola, con la capacidad de actuar sobre este organismo por más días, resistir el lavado por la lluvia, ya que podían ser absorbidas y translocadas por la planta, y curar infecciones en desarrollo (Massi et al., 2021). En la actualidad, estos fungicidas, denominados “sistémicos”, se aplican en todo el mundo, en una gran variedad de cultivos; no obstante, en la mayoría de las regiones vitícolas, se han descubierto poblaciones de P. viticola resistentes a diversos grupos de fungici- das, cuya resistencia apareció tan pronto como estos productos empezaron a usarse (Wicks et al., 2005; Baudoin et al., 2008; Furuya et al., 2010; Lucas et al., 2015; Hall et al., 2017; Zhang et al., 2017; Toffolatti et al., 2018b; Campbell et al., 2020; Ghule et al., 2020; Santos et al., 2020b; Campbell et al., 2021; Massi et al., 2021). A la fecha, existen 12 grupos de fungicidas disponibles para el control de oomi- cetes fitopatógenos (Cuadro 1), sin embargo para tres de los más ampliamente uti- lizados: fenilamidas (PAs), inhibidores externos de la quinona (QoIs) y amidas de ácidos carboxílicos (CAAs), se han reportado más casos de resistencia por parte de P. viticola y de otros mildiús vellosos (Gisi y Sierotzki, 2015). Las malas prácti- cas asociadas a la repetida aplicación de estos fungicidas aceleran este fenómeno,
Cuadro 1 Lista de ingredientes activos disponibles para el control de oomicetes, divididos según el modo de acción FRAC y grupo químico, modificada de Hollomon (2015).
| Modo de acción FRAC | Modo de acción FRAC | Grupo químico | Nombre común (ingrediente activo) |
|---|---|---|---|
| Metabolismo de ácidos nucleicos | PAs (Fenilamidas) | Acilalaninas | Metalaxil, Mefenoxam, Benalaxil, Kiralaxil |
| Oxazolidinones | Oxadixyl | ||
| Desconocido | Oximas de cianoacetamida | Oximas de cianoacetamida | Cymoxanil |
| Citoesqueleto/ proteínas motoras | Benzamidas | Piridinilmetil-benzamidas Toluamidas | Fluopicolida Zoxamida |
| Tiazol carboxamida | Etilamino-tiazol carboxamida | Etaboxam | |
| Biosíntesis de pared celular | CAAs (Amidas de ácidos carboxílicos) | Amidas de ácido cinámico | Dimetomorf, Flumorf |
| Amidas de ácido mandélico | Mandipropamida | ||
| Carbamatos de valinamida | Iprovalicarb, Bentiavalicarb | ||
| Respiración | QoIs (Inhibidores externos de la quinona) | Oxazolidin-dionas | Famoxadona |
| Imidazolinonas | Fenamidona | ||
| Metoxiacrilatos (estrobilurinas) | Azoxistrobina | ||
| QiIs (Inhibidores internos de la quinona) | Ciano-imidazoles | Ciazofamida | |
| Sulfamoil-triazoles | Amisulbrom | ||
| 2,6- dinitroanilinas | Fluazinam | ||
| QoSIs (enlace tipo estigmetalina) | Triazolo-primidilamina | Ametoctradina | |
| Multisitio | Ditiocarbamatos | Ditiocarbamatos | Mancozeb |
| Cloronitrilos/Ftalonitrilos | Cloronitrilos | Clorotalonil | |
| Inorgánicos | Inorgánicos | Cobre (sales) | |
| Inductor de resistencia | Fosfonatos | Etil fosfonatos | Fosetil-Al |
y conducen a la pérdida de eficacia de los productos comerciales. Esta situación no solo dificulta la disminución progresiva de poblaciones resistentes, sino que también impide mitigar el avance de la enfermedad una vez presente (Hollomon, 2015).
Además del costo económico que implica el combate del mildiú velloso, estima- do por Taylor y Cook (2018) en USD $5 millones al año, la resistencia a los fungici- das ocasiona que la cantidad de productos efectivos para manejar esta enfermedad sea cada vez menor. Plasmopara viticola es descrito como un organismo cuyo ries- go para desarrollar resistencia es alto, debido a la alta tasa de reproducción asexual y sexual, así como el comportamiento policíclico de las epidemias (Toffolatti et al., 2011; Fungicide Resistance Action Committee [FRAC], 2019). El riesgo de resistencia es mayor para los fungicidas que actúan sobre un único sitio bioquímico (Gisi y Sierotzki, 2008; Massi et al., 2021); no obstante, múltiples aplicaciones con estos productos son realizadas cada año, pese a que algunos estudios concluyen que el control curativo no es eficaz para contener el progreso de las epidemias de mildiú velloso (Hollomon, 2015; Massi et al., 2021; Poeydebat et al., 2022).
Una estrategia recomendada para el manejo de la resistencia consiste en la di- versificación de compuestos con distintos modos de acción en las aplicaciones. Es aconsejable que los fungicidas de acción sistémica sean combinados con aquellos que actúan a nivel multisitio, y de esta forma, reducir la selección de poblaciones resistentes a la molécula de mayor riesgo (Brent y Hollomon, 2007; van den Bosch, 2014; Kassemeyer et al., 2015; Elderfield et al., 2018). Sumado a esto, el uso de mezclas de fungicidas propicia la acción sinérgica potencial entre las moléculas, lo cual promueve un efecto residual más prolongado (Gisi, 1996; van de Bosch, 2014).
El daño relativo que representa esta enfermedad sobre la viticultura supera el provocado por otros mildiús vellosos en sus respectivos hospederos (Gisi y Sierotzki, 2008). Esto genera que el combate químico sea la práctica de manejo más utilizada en el mundo para asegurar rendimientos óptimos (Toffolatti et al., 2018a; Massi et al., 2021), situación que posiciona la viticultura como una de las actividades agrícolas con mayor consumo de plaguicidas; solo en Europa, más del 70 % del mercado de los fungicidas es destinado a este cultivo (Muthmann y Nadin, 2007; Sargolzaei et al., 2020; Wingerter et al., 2021). Este panorama sustenta la discusión en torno al impacto negativo de los plaguicidas en la salud y el ambiente, de modo que las prácticas modernas deben incluir alternativas de manejo más sos- tenibles (Romanazzi et al., 2016; Yu et al., 2022).
Con el objetivo de reducir la carga química en los sistemas convencionales, han surgido otros enfoques para el manejo integrado de esta enfermedad, en los que se ha dado mayor importancia a la resistencia innata de especies silvestres de Vitis americanas (V. labrusca, V. rotundifolia, V. rupestris, V. riparia y V. cinerea) y asiáticas (V. amurensis, V. piasezkii y V. coignetiae), las cuales exhiben resistencia parcial o total a la enfermedad, conferida por múltiples genes de resistencia (R) (Merdinoglu et al., 2018; Koledenkova et al., 2022). Si bien estas variedades no son cultivadas para el mercado vinícola, la existencia de este germoplasma signi- fica un recurso valioso para los programas de mejoramiento orientados a generar materiales con resistencia al mildiú velloso y otros factores de estrés biótico y abió- tico (Moreira et al., 2011; Yu et al., 2012; Toffolatti et al., 2016; Buonassisi et al., 2017).
El desarrollo de variedades con resistencia genética es la alternativa más sos- tenible para combatir las enfermedades de la vid y disminuir el uso de plaguicidas (Mundt, 2014; Zini et al., 2019; Fröbel et al., 2019), pero las técnicas de mejora- miento convencional son costosas, y la observación de los resultados puede tardar hasta 30 años (Eibach y Töpfer, 2015; Sargolzaei et al., 2020).
La necesidad de introducir los genes R de las especies silvestres en las varie- dades cultivadas susceptibles ha generado que, desde principios del siglo XX, se hayan desarrollado y registrado miles de híbridos con mayor resistencia a la enfer- medad (Pacifico et al., 2013). Sin embargo, durante la hibridación, los parentales silvestres segregan caracteres que modifican las propiedades químicas de las uvas, lo que se traduce en vino de baja calidad. Por esta razón, la mayoría de estos híbri- dos han sido descartados del mercado (Eibach y Töpfer, 2015; Pertot et al., 2017; Toffolatti et al., 2018a; Foria et al., 2022).
Para superar las dificultades asociadas a la duración del mejoramiento conven- cional y al valor vinícola de los híbridos, el uso de marcadores moleculares ha permitido detectar los principales QTLs (locus de rasgo cuantitativo) de especies silvestres asociados a los distintos grados de resistencia al mildiú velloso, lo cual facilita la evaluación de los genotipos que albergan los genes R (Zyprian et al., 2016; Merdinolgu et al., 2018; Sargolzaei et al., 2020). A través del mapeo de los QTLs que intervienen en mayor y menor medida a la resistencia, se pueden encontrar asociaciones significativas entre los marcadores moleculares y los feno- tipos resistentes a esta enfermedad (Divilov et al., 2018; Possamai y Wiedemann- Merdinoglu, 2022). Este conocimiento constituye la base para la selección asistida por marcadores, mediante la cual se ha reducido considerablemente el proceso de mejoramiento, ya que se pueden identificar, desde el estado de plántula, las varieda- des candidatas que combinan no solo diversos factores de resistencia, sino también características agronómicas importantes como la calidad y el rendimiento (Fischer et al., 2004; Eibach y Töpfer, 2015; Merdinolgu et al., 2018; Fu et al., 2020).
Las prácticas agronómicas actuales para el manejo integrado de esta enfermedad consideran la relación entre las variables climáticas y el progreso de las epide- mias, con el propósito de identificar el inicio de las infecciones primarias y otros momentos críticos para los cuales es necesario realizar aplicaciones (Caffi et al., 2011; Gessler et al., 2011). A través del registro de la temperatura, humedad re- lativa, precipitación y mojadura foliar, se pueden crear modelos de pronóstico de estas epidemias. Estas predicciones son integradas a sistemas de alerta para asistir en la toma de decisiones durante los momentos de mayor susceptibilidad, cuyo fin consiste en optimizar al máximo el efecto de las aplicaciones (Madden et al., 2000; Dalla Marta et al., 2005; Rossi et al., 2013; Brischetto et al., 2021).
Con relación a las estrategias de manejo cultural, es conveniente controlar la humedad tanto a nivel de suelo como de dosel (Thind et al., 2004; Mian et al., 2021), emplear maquinaria y material vegetativo limpio, sembrar a una densidad óptima, y mantener el nivel de nitrógeno equilibrado (Taylor, 2021). En sistemas agroecológicos y orgánicos, como alternativa al cobre, se utilizan inductores para promover la activación del sistema de defensa de la planta, previo a los eventos de infección. La aplicación preventiva de estas sustancias contribuye a disminuir el uso de fungicidas, puesto que toma ventaja de la inducción temprana de las res- puestas de resistencia (Guerreiro et al., 2016; Jacquens et al., 2022).
Entre los inductores más estudiados, se ha demostrado que el quitosano, aplicado de forma preventiva, reduce la severidad en hojas de vid a nivel de invernadero (Aziz et al., 2006; Llamazares De Miguel et al., 2022) y campo (Vitalini et al., 2020; Taibi et al., 2022; Mian et al., 2023), a través de un aumento en la acumulación de ácido salicílico y fitoalexinas en los tejidos, así como una sobreexpresión de genes para la síntesis de proteínas relacionadas a la patogénesis (PR) (Aziz et al., 2006; Inchaya et al., 2013; Mian et al., 2023). Por otro lado, Romanazzi et al. (2021) y Vitalini et al. (2020) determinaron que distintas formulaciones individuales de quitosano, o en mezcla con cobre, permiten reducir la incidencia y severidad en hojas y racimos, ante baja y alta presión de la enfermedad en viñedos comerciales. Efectos similares al quitosano han sido reportados al utilizar laminarina, un glu- cano derivado del alga Laminaria digitata. La aplicación de esta sustancia promueve la expresión de genes de defensa y proteínas PR (Aziz et al., 2003; Gauthier et al., 2014). Asimismo, su eficacia para el control del mildiú velloso en invernadero y campo ha sido comprobada, en aplicaciones individuales o combinadas con cobre (Paris et al., 2016; Romanazzi et al., 2016; Taibi et al., 2023).
La inducción de estos mecanismos de resistencia también se ha encontrado al utilizar ácido β- aminobutírico (BABA), cuyo efecto sobre la enfermedad se ha observado en ambientes controlados (Hamiduzzaman et al., 2005; Slaughter et al., 2008; Dagostin et al., 2011) y a nivel de campo (Reuveni et al., 2001), y el benzo- tiadiazol (BTH), compuesto sintético análogo al ácido salicílico, el cual favorece la síntesis de fitoalexinas (Dufour et al., 2012; Burdziej et al., 2021) y permite reducir la incidencia y severidad de la enfermedad en condición de invernadero (Dagostin et al., 2006; Perazzolli et al., 2008; Harm et al., 2011). Sin embargo, solo el BTH existe como producto comercial (Bion® 50 WG, Syngenta).
La acción de hongos endófitos como potenciales biocontroladores también ha tomado mayor importancia. Se han identificado individuos de Acremonium sp., A persicinum, A. sclerotogenum, A. byssoides y Alternaria alternata¸ cuyos metaboli- tos en condición in vitro muestran actividad anti-germinativa sobre los esporangios de P. viticola (Assante et al., 2005; Musetti et al., 2006; Arnone et al., 2008; Lo Piccolo et al., 2015). Por otro lado, a través de mecanismos como hiperparasitismo y lisis enzimática, Epicoccum nigrum y Fusarium proliferatum, respectivamente, han exhibido control sobre P. viticola a nivel in vitro (Bakshi et al., 2001; Korte- kamp, 1997; Shen et al., 2017).
De igual manera, cepas de bacterias endófitas como Bacillus subtilis, B. pu- milus, B. altitudinis, Ochrobactrum sp. y Pseudomonas fluorescens han resultado efectivas para reducir el impacto del mildiú velloso en invernadero y en campo (Furuya et al., 2011; Zhang et al., 2017; Lakkis et al., 2019; Zang et al., 2020; Zeng et al., 2021).
Otros organismos no endófitos de los que se ha reportado control sobre P. viti- cola incluyen Trichoderma koningiopsis y formulaciones comerciales con T. har- zianum T9, las cuales además poseen efecto inductor de resistencia (Perazzolli et al., 2008; Kamble et al., 2021; Palmieri et al., 2021; Küpper et al., 2022). En otro estudio, Bolzonello et al. (2023) encontraron que, al utilizar de forma preventiva análogos sintéticos de metabolitos secundarios de Trichoderma spp. sobre discos de hoja, las células de P. viticola mostraron ruptura de membranas y granulación citoplasmática, lo que representó un nivel de protección similar a un fungicida cúprico.
En cuanto a bacterias, se determinó que Lysobacter capsici AZ78, Streptomyces atratus PY-1 y S. viridosporus HH1, disminuyen la severidad de la enfermedad (Puopolo et al., 2014; Liang et al., 2016; El-Sharwaky et al., 2018; Brescia et al., 2021; Markellou et al., 2022). Por su parte, Pozzebon y Duso (2008) registraron que los ácaros Amblyseius andersoni y Typhlodromus pyri se alimentan de micelio y esporas de P. viticola, lo que los presenta como candidatos para el control biológico.
Problemática y manejo en Costa Rica
De los problemas fitosanitarios presentes en las plantaciones de Costa Rica, el mildiú velloso es el más limitante, provocando pérdidas que, aunque no han sido estimadas, se han observado en diferente magnitud. Para su manejo, los viticulto- res realizan deshijes, podas constantes, y aplican sales de cobre y mancozeb como control preventivo, ya que el combate químico está sujeto a un ingrediente activo. Asimismo, cuando la presencia de inóculo es alta, se realiza una limpieza sanitaria de las hojas más afectadas y se remueven de la plantación.
En el caso de los productores que tienen materiales descendientes de V. labrusca en sus viñedos, el mildiú velloso no representa un problema significativo. Entre estos, el híbrido Isabella (V. labrusca × V. vinifera) es el más común en las planta- ciones de clima cálido, tanto por su tolerancia a la enfermedad, como por ser el que mejor se ha adaptado a las condiciones tropicales. Puesto que la actividad en Costa Rica es incipiente, no se han implementado técnicas de mejoramiento molecular para desarrollar materiales que resistan el mildiú velloso, ni tampoco se ha reporta- do el uso de controladores biológicos efectivos de este patógeno.
Con excepción del híbrido Isabella, en la mayoría de las variedades sembradas en el país, esta enfermedad genera pérdidas en la productividad. Entre ellas, la va- riedad Syrah es altamente susceptible; sin embargo, también se ha destacado como uno de los cultivares de clima templado con mayor potencial para vinicultura en zonas tropicales (Camargo et al., 2011; Tonietto y Pereira, 2011; Commins et al., 2012; Wurz et al., 2017). Esta variedad se cultiva únicamente en el viñedo más tecnificado del país, ubicado en Dota, y se considera de alta calidad para elaborar vino. Por estas razones, es importante dilucidar estrategias de manejo que reduzcan el impacto de las epidemias.
Un obstáculo en la producción de Syrah en Dota es el retraso en el crecimiento, en comparación al ciclo fenológico que se observa en las regiones templadas (Se- rrano-Segura, 2020, comunicación personal). Esta condición genera que el periodo vegetativo sea más prologando y, por lo tanto, que el patógeno se reproduzca por más tiempo. Sumado a esto, las condiciones climáticas del lugar permiten que se cumpla la regla 3-10 para las infecciones primarias de mildiú velloso de la vid, de acuerdo con Rossi et al. (2013): 10 cm de tejido foliar, al menos 10 mm de lluvia en las últimas 48 h, y más de 10 ºC.
Como parte del manejo agronómico de Syrah, después de la vendimia, las plan- tas permanecen con poco mantenimiento mientras las hojas translocan los nutrien- tes restantes al tronco, para que acumulen las reservas necesarias para la brotación del siguiente ciclo, tras lo cual se aplica nitrato de amonio a una dosis alta como quemante. Más tarde, las ramas productivas del periodo anterior se podan para dar origen a los hijos productivos del siguiente ciclo, y luego se les aplica un compen- sador de frío para romper la dormancia de las yemas laterales que, aproximadamen- te un mes después, brotarán e iniciarán un nuevo ciclo de cultivo, así como también del patógeno.
En el viñedo de Dota, se ha evaluado una amplia variedad de fungicidas de contacto, translaminares y sistémicos, para determinar su eficacia contra la enfer- medad; sin embargo, la eficacia de algunos ingredientes activos ha disminuido a través del tiempo. Se ha observado que los productos de contacto a base de cobre no son efectivos durante la época lluviosa, mientras que, algunos fungicidas sisté- micos probados han ocasionado toxicidad a dosis comerciales o menores. Por otro lado, los productos biológicos formulados con B. subtilis tampoco han generado un buen resultado, de acuerdo con estimaciones visuales en el avance de la epidemia.
La falta de nuevos ingredientes activos permitidos en Costa Rica para el manejo de esta enfermedad representa un obstáculo no solo en la producción de Syrah, sino también en las demás variedades cultivadas en Dota y en el resto del país. En la actualidad, de los 25 ingredientes activos disponibles en el mundo para el control de oomicetes fitopatógenos (Cuadro 1), en Costa Rica, solo el mancozeb está permitido para el combate del mildiú velloso de la vid. Si bien este fungicida es utilizado en todas las regiones vitícolas, con excepción de la Unión Europea (Debelder, 2020), su uso individual en un programa de aplicaciones no es suficiente para combatir las epidemias en Dota, donde, además, las condiciones climáticas favorecen el desarrollo acelerado de la enfermedad. Estas razones hacen oportuno determinar el efecto de nuevas moléculas y mezclas que eventualmente puedan registrarse para su uso en la vid.
Durante el periodo 2019-2020, el mejor resultado en finca, en términos de ren- dimiento, para el combate del mildiú velloso en la variedad Syrah, se obtuvo al aplicar un fungicida a base de ciazofamida. No obstante, esta molécula solo se encuentra registrada para el control de Phytophthora infestans en papa y tomate, y Pseudoperonospora cubensis en melón y sandía, dos oomicetes fitopatógenos de gran impacto económico para la agricultura.
En una investigación realizada durante el ciclo productivo 2020-2021 (datos sin publicar) se determinó que tanto la ciazofamida como la mezcla de cimoxanilo + fosetil-Al + mancozeb fueron efectivos para reducir el impacto de la enfermedad. Estos resultados demuestran la importancia de realizar ensayos de eficacia biológi- ca de moléculas que no han sido evaluadas en este patosistema, lo cual proporciona un acercamiento hacia nuevos registros, con la meta de continuar en la búsqueda de estrategias que permitan establecer un manejo integrado y sostenible de la acti- vidad.
Conclusiones
Los cambios en la distribución global de la viticultura han despertado el inte- rés de valorar las zonas tropicales como potenciales regiones para explotar esta actividad. No obstante, las condiciones de temperatura y humedad presentes en los trópicos favorecen la aparición y los daños ocasionados por el mildiú velloso y otras enfermedades. Por otro lado, la resistencia de P. viticola a diversos fungi- cidas, sumada a la transición hacia mercados agroecológicamente más sostenibles, representan desafíos para los sistemas convencionales actuales, los cuales deben enfocar sus esfuerzos hacia estrategias de manejo integrado que prioricen el uso de variedades resistentes y prácticas preventivas, con la meta de reducir y optimizar el uso de fungicidas sintéticos.
En Costa Rica, la ausencia de información técnica sobre el manejo agronómico de la vid, así como de recursos fitosanitarios para el combate del mildiú velloso, representan obstáculos en el progreso de la actividad vitícola existente. A pesar de esto, la diversidad en las zonas del país en donde existen plantaciones demuestra que existe la posibilidad de desarrollar este mercado, razón por la cual es importante explorar formas de manejo fitosanitario. Para determinar estrategias efectivas en el combate de esta enfermedad, es preciso evaluar el comportamiento de los agentes biocontroladores reportados, así como de nuevas moléculas sintéticas, en un entorno tropical como Costa Rica, con el objetivo de identificar los insumos con mejor eficacia.











 texto en
texto en